
分析 (1)①K为生成物浓度幂之积与反应物浓度幂之积的比;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,结合v=$\frac{△c}{△t}$计算;
(2)利用等、定判定平衡状态.
解答 解:(1)①由Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,则10min内CO的平均反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L.min),
故答案为:0.015mol/(L.min);
(2)由反应及平衡的特征可知,CO或CO2的浓度不变、CO或CO2的正逆反应速率相同,均说明该反应已达到化学平衡状态,
故答案为:CO或CO2的浓度不变;CO或CO2的正逆反应速率相同.
点评 本题考查化学平衡常数及计算,为高频考点,把握平衡常数表达式、速率计算、平衡判定为解答的关键,注意固体不能在K的表达式中,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中二氧化碳的体积分数不变 | |
| B. | 密闭容器中气体的总物质的量改变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 2v(NH3)正=v(CO2)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯酚显酸性,是因为羟基对苯环影响的结果 | |
| B. | 分子式为C2H4和C3H6的物质一定互为同系物 | |
| C. | 聚合物  是苯酚和甲醛在一定条件下反应得到的高分子化合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 | |
| D. | 1mol 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )
”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )| A. | 比石墨高 | B. | 比石墨低 | ||
| C. | 低于石墨而高于金刚石 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的晶体中每个水分子可与周围两个水分子形成氢键 | |
| B. | 手性碳原子不一定是饱和碳原子 | |
| C. | 区分晶体与非晶体最科学的方法是X-射线衍射法 | |
| D. | 晶体中有阳离子就一定有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
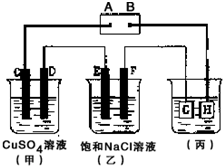 如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:
如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com