
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
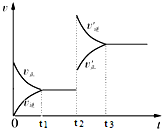 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )| A. | 重新达到平衡后,平衡常数K增大 | B. | t2时刻改变的条件可以是升高温度 | ||
| C. | I2(g)转化率增大,HI平衡浓度增大 | D. | t2时刻改变是可以增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只被氧化 | B. | 被氧化与被还原的个数比为1:3 | ||
| C. | 只被还原 | D. | 氧化剂与还原剂的质量比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com