
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫����6molL��1 H2SO4��Һ�У���ͬѧ���缫����6molL��1��NaOH��Һ�У���ͼ��ʾ��
��ش�
��1��д���׳��������ĵ缫��Ӧʽ�� ��
��2��д���ҳ��и����ĵ缫��Ӧʽ���ܷ�Ӧ�����ӷ���ʽ������ �� �ܷ�Ӧ�����ӷ���ʽΪ ��
��3���ɴ�ʵ�飬�ɵõ�������Щ��ȷ���ۣ�����д��ĸ��ţ���a������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
b��þ�Ľ����Բ�һ�������Ľ�����ǿ
c����ʵ��˵���������˳���ѹ�ʱ����û��ʵ�ü�ֵ
d����ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
��4������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳���ж�ԭ����е�����������������������ɿ������ɿ�������
���𰸡�
��1��2H++2e��=H2��
��2��Al+4OH����3e��=AlO ![]() +2H2O��2Al+2OH��+2H2O=2AlO
+2H2O��2Al+2OH��+2H2O=2AlO ![]() +3H2��
+3H2��
��3��ad
��4�����ɿ�
���������⣺��1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪMg��2e��=Mg2+ �� ������ӦΪ2H++2e��=H2�������Դ��ǣ�2H++2e��=H2������2���ҳ�������ʧ��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Al+4OH����3e��=AlO ![]() +2H2O��þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al+2OH��+2H2O=AlO
+2H2O��þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al+2OH��+2H2O=AlO ![]() +3H2�������Դ��ǣ�Al��Al+4OH����3e��=AlO
+3H2�������Դ��ǣ�Al��Al+4OH����3e��=AlO ![]() +2H2O��2Al+2OH��+2H2O=2AlO
+2H2O��2Al+2OH��+2H2O=2AlO ![]() +3H2������3��a�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ���A��ȷ�� b��þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ���B���� c����ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ����C���� d����ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ������������������D��ȷ�����Դ��ǣ�ad����4������ʵ��˵������ֱ�����ý������˳����жϵ���е����������������ɿ�������ǽ�һ�������ƣ�ͨ���۲���������ж�ԭ��ص������������Դ��ǣ����ɿ���
+3H2������3��a�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ���A��ȷ�� b��þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ���B���� c����ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ����C���� d����ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ������������������D��ȷ�����Դ��ǣ�ad����4������ʵ��˵������ֱ�����ý������˳����жϵ���е����������������ɿ�������ǽ�һ�������ƣ�ͨ���۲���������ж�ԭ��ص������������Դ��ǣ����ɿ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mLŨ��Ϊ2mol/LH NO3��3mol/LH2SO4�Ļ����Һ�м���1.92��ͭ����ַ�Ӧ������Һ�����Ϊ10mL����
��1�������������ڱ�״���µ����Ϊ��������
��2����Ӧ����Һ�и����ʵ�����Ũ���Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��53.7kJmol��1 ��
CO2��g��+H2��g��CO��g��+H2O��g����H2 ��
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2.2������ͬѹǿ�£�������ͬ��Ӧʱ��������ʵ�����ݣ�
T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[��ע]Cat.1��Cu/ZnO���װ���Cat.2��Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0kJmol��1�ͩ�285.8kJmol��1 ��
��H2O��1���TH2O��g����H3=44.0kJmol��1
��ش𣨲������¶ȶԡ�H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK=����Ӧ��ġ�H2=kJmol��1 ��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A.ʹ�ô���Cat.1
B.ʹ�ô���Cat.2
C.���ͷ�Ӧ�¶�
D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E.���� CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
��4������ͼ�зֱ���ӦI����������Cat.1����Cat.2��������¡���Ӧ���̩�������ʾ��ͼ��
��5���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ�����������õ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����(����)
A. ɳ�ӡ�ʯӢ��ˮ������Ҫ�ɷֶ���SiO2
B. �Ʋ�����ˮ���ԭ�϶��õ�ʯ��ʯ
C. ���ڳ����²������������������ᷴӦ
D. һ��������SiO2����������ᷴӦ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��E��ԭ������������������B��Eͬ���壮AԪ�ص���������ϼۺ�������ϼ۵ľ���ֵ֮��Ϊ2��1molC��������ˮ��Ӧ���ڱ�״��������11.2L H2��Dԭ����������������������������E���ĵ��Ӳ�ṹ��Arԭ����ͬ��
��1��д������Ԫ������D��E��
��2������Ԫ�ض�Ӧ��ԭ�Ӱ뾶��С�������Ӱ뾶����������Ԫ�ط��ţ�
��3��A�ĵ��ʵĵ���ʽΪ
��4���õ���ʽ��ʾC��B�γɻ�������γɹ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɣ�
��1����ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������Ԫ�ص���̼����ǽ�����ǿ���Ƚϵ�ʵ���о�����֪A��ǿ�ᣬB�ǿ�״���壻��Һ©���Ļ����ɿ����д������ݲ������ձ��пɹ۲쵽��ɫ�������ɣ�
�ټ�ͬѧ���ʵ�������������
��д��ѡ�õ����ʣ�A �� B �� C���ѧʽ��
���ձ��з�Ӧ�����ӷ���ʽΪ
����ͬѧ��Ϊ��ͬѧ��Ƶ�ʵ�鲻���Ͻ���Ӧ��B��C֮������һ��ϴ��װ�ã���װ����Ӧʢ����Һ�����Լ����ƣ���Ŀ����
��2����ͬѧ�������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɣ�A��B��C�����ֱ���մ��NaBr��Һ������ʪ�����KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ������������A����ʵ������Ϊ��д��B����Ӧ�����ӷ���ʽ����NaBr��KI�Ļ����Һ�У�ͨ��������Cl2��ַ�Ӧ��������Һ���ɲ����գ����õ���������
�ڱ�ͬѧ���ô�ʵ��֤��±�ص��������ԣ�Cl2��Br2��I2 �� ����Ϊ��������������������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����ϵͳ��������ȷ��һ���ǣ� ��
A.�����顡 C��CH3��4
B.3���һ���1����ϩ�� ![]()
C.2������2��4������ϩ�� ![]()
D.2��2��3���������顡 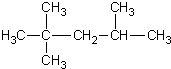
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.������ƿ������Һʱ����������ˮϴ�ӣ����ô�װҺ��ϴ
B.�������ɺ���Fe3��������ˮ��ȡ�ϴ�����ˮ
C.��ɫ��Ӧ����ϡ����ϴ�Ӳ�˿���ڻ�������������ɫ���ٽ����������ʵIJ���
D.����þ�Ż����ɳ�Ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
��1������0.50mol/L NaOH��Һ
a.��ʵ���д�ԼҪʹ��245mL NaOH��Һ��������Ҫ����NaOH���� g��
b.��ͼ��ѡ�����NaOH��������Ҫ�������ǣ�����ĸ���� ��
���� | ������ƽ�������룩 | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
���� |
|
|
|
|
|
|
��� | a | b | c | d | e | f |
��2���ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��
a.д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3kJ/mol���� ��
b.ȡ50mL NaOH��Һ��30mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
�¶� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ��t2��t1��/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�ڽ�����Ϊ0.50mol/L NaOH��Һ��0.50mol/L������Һ���ܶȶ���1g/cm3 �� �кͺ�������Һ�ı�����c=4.18J/��g�棩�����к��ȡ�H=��ȡС�����һλ����
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ������ǣ�����ĸ�� ��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶ȣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com