
| A. | 金属铝溶于稀硫酸中:Al+2H+═A13++H2↑ | |
| B. | 少量Cl2通入KI溶液中:Cl2+2I-═2C1-+I2 | |
| C. | 醋酸钠水溶液中通入足量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| D. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ |
分析 A.2mol铝与稀硫酸完全反应生成3mol氢气,该反应不满足电子守恒、电荷守恒;
B.氯气将碘离子氧化成碘单质;
C.碳酸的酸性比醋酸弱,醋酸钠与二氧化碳不发生反应;
D.碳酸锌为难溶物,离子方程式中不能拆开.
解答 解:A.金属铝溶于稀硫酸中生成硫酸铝和氢气,正确的离子方程式为:2Al+6H+═2A13++3H2↑,故A错误;
B.少量Cl2通入KI溶液中生成氯化钾和碘单质,反应的离子方程式为:Cl2+2I-═2C1-+I2,故B正确;
C.醋酸钠水溶液中通入足量CO2,由于碳酸的酸性小于醋酸,二者不发生反应,故C错误;
D.碳酸锌不能拆开,正确的离子方程式为:ZnCO3+2H+=Zn2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: | B. | 氯化氢的电子式:H:Cl | ||
| C. | 乙烷的分子式:C2H6 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 +Br2→BrCH2CH2CH2CH2CH2Br
+Br2→BrCH2CH2CH2CH2CH2Br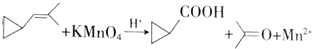
| A. | 环烷烃与烷烃都是饱和烃,所以具有相同的通式 | |
| B. | B所有的饱和烃都不能发生加成反应 | |
| C. | 可用溴水鉴别丙烯与环丙烷 | |
| D. | 可用酸性高锰酸钾溶液鉴别丙烯与环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙的电子式为
,丙的电子式为 ;E在周期表中的位置为第三周期VA族;
;E在周期表中的位置为第三周期VA族;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性<W的氢化物稳定性 | |
| C. | Y的氧化物既能与盐酸,又能与NaOH溶液反应 | |
| D. | X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com