
分析 (1)非金属性越强,最高价氧化物对应的水合物的酸性越强,据此设计反应原理;
(2)根据得失电子数相等配平反应方程式,注意依据代数和为0判断元素的化合价;
(3)①从Na元素质量守恒的角度解答;
②根据NaNO2和NaNO3的物质的量,利用反应的化学方程式解答;
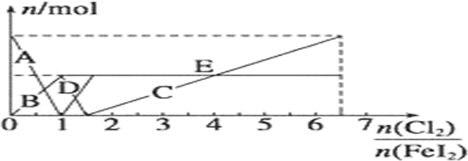
(4)由还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-;可见当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氧化还原反应完毕;因此当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量,故粗线C代表了n(Fe3+)的变化;
当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线E的起点若从1.5出发至6.5结束,则细线E代表了n(IO3-)的变化;
当n(Cl2):n(FeI2)<1时,碘离子反应生成碘单质,碘离子浓度减小至1时为0,碘单质的浓度最大,为原来碘离子浓度的一半,所以A代表了n(I-)的变化,B代表了n(I2)的变化;
当1.5≥n(Cl2):n(FeI2)>1:1时,Fe2+浓度减少至1.5时,Fe2+达到最小量为0,故粗线D代表了n(Fe2+)的变化,然后结合发生的离子反应解答.
解答 解:(1)非金属性越强,最高价氧化物对应的水合物的酸性越强,根据CO2+Na2SiO3+H2O=Na2CO3+H2SiO3可知,碳酸的酸性大于硅酸,则C元素的非金属性大于Si,
故答案为:CO2+Na2SiO3+H2O=Na2CO3+H2SiO3;
(2)FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,该反应,FeSO4中Fe的化合价为+2价,K2FeO4中Fe的化合价为+6价,所以一个氯化亚铁分子失去4个电子;K2O2中O的化合价为-1价,O2中O的化合价为0价,一个K2O2分子失去2个电子生成氧气;K2O2中O的化合价为-1价,K2FeO4和K2O中O元素的化合价为-2价,所以一个K2O2失去2个电子,该方程式中得失电子的最小公倍数为6,所以该方程式的计量数分别为2、6、2、2、2、1,即方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案为:2;6;2;2;2;1;
(3)①n(NaNO3)=n(NO3-)=0.02mol,
n(NaOH)=0.05L×2mol/L=0.1mol,
根据Na元素质量守恒,则
n(NaOH)=n(NaNO3)+n(NaNO2),
n(NaNO2)=0.1mol-0.02mol=0.08mol,
故答案为:0.08;
②设混合气体中含有xmolNO,ymolNO2,
NO2+NO+2NaOH→2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH→NaNO2+NaNO3+H2O
2 1 1
(y-x) $\frac{1}{2}$(y-x) $\frac{1}{2}$(y-x)
则2x+$\frac{1}{2}$(y-x)=0.08、$\frac{1}{2}$(y-x)=0.02,
解得:x=0.03、y=0.07,
所以x:y=3:7,
故答案为:3:7;
(4)由还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-;可见当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氧化还原反应完毕;因此当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量,故粗线C代表了n(Fe3+)的变化;
当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线E的起点若从1.5出发至6.5结束,则细线E代表了n(IO3-)的变化;
当n(Cl2):n(FeI2)<1时,碘离子反应生成碘单质,碘离子浓度减小至1时为0,碘单质的浓度最大,为原来碘离子浓度的一半,所以A代表了n(I-)的变化,B代表了n(I2)的变化;
当1.5≥n(Cl2):n(FeI2)>1:1时,Fe2+浓度减少至1.5时,Fe2+达到最小量为0,故粗线D代表了n(Fe2+)的变化,
①当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则n(C1-):n(IO3-)=26:4=13:2=6.5,
故答案为:6.5;
②当n(Cl2):n(FeI2)=1.2时,碘离子全部被氧化,亚铁离子部分氧化,则离子反应为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-,
故答案为:2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-.
点评 本题考查了氧化还原反应的计算、离子方程式的计算等知识,题目难度较大,注意图形曲线变化的含义为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 待测液 体积(mL) | 标准液 | |||||
| 浓度(mol/L) | 滴定前 | 滴定后 | 体积(mL) | 平均值(mL) | ||
| 第一次 | 20.00 | 0.0200 | 0.00 | 14.30 | ||
| 第二次 | 0.20 | 12.22 | ||||
| 第三次 | 0.00 | 11.98 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化都是化学变化 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 铁、铝、铜在空气中长期放置表面都会生成氧化物 | |
| D. | 二氧化硫可广泛用于食品的增白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下物质的量浓度相等的①(NH4)2CO3溶液、②(NH4)2SO4溶液和③NH4Cl溶液中,水的电离程度:①>③>② | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-) | |
| C. | 某溶液中水电离出的c(H+)=1.0×10-12mol/L,则此溶液中K+、HCO3-、Cl-、SO32-可以大量共存 | |
| D. | 0.1mol氯气与足量氢氧化钠溶液(常温)反应,转移电子0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com