
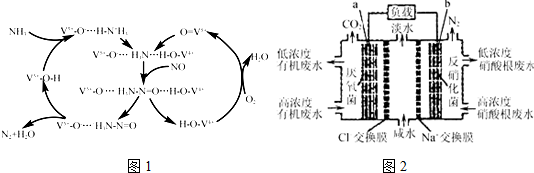
分析 (1)①光化学烟雾(或硝酸型酸雨)都是氮的氧化物引起的;
②已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
③氮的化合价降低,所以氧化剂是一氧化氮;
(2)该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,据此分析解答.
解答 解:(1)①光化学烟雾(或硝酸型酸雨)都是氮的氧化物引起的,故答案为:光化学烟雾(或硝酸型酸雨);
②已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1;
故答案为:-1250.3 kJ•mol-1;
③氮的化合价降低,所以氧化剂是一氧化氮,故答案为:NO;
(2)该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,
①该原电池中,硝酸根离子得电子发生还原反应,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,则右边装置中电极b是正极,故答案为:b;
②左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故答案为:C6H10O5-24e-+7H2O═6CO2↑+24H+;
③放电时,电解质溶液中阳离子Na+移向正极右室即向b电极,阴离子Cl-移向负极室左室即a电极,故答案为:b电极;a电极;
④整个电路转移120mol电子时,负极生成30mol的二氧化碳气体,正极生成12mol的氮气,除理氯化钠120mol,得到关系式为:
42mol气体~120molNaCl,
42×22.4 120×58.5
7.84 2.34%×m
则42×22.4×2.34%×m=7.84×120×58.5,解之得x=2500g,故答案为:2500.
点评 本题考查化学反应热和化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.


科目:高中化学 来源: 题型:选择题
| A. | 把没用完的药品倒回原试剂瓶中保存 | |
| B. | 配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸 | |
| C. | 用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码 | |
| D. | 用排水取气法收集气体时,导管应插入试管底部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH. 2SO3(g)△H=-197KJ/mol.
2SO3(g)△H=-197KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
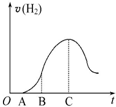 把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| B. | 20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8g石墨中的共价键数目 | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数 | |
| C. | 一定条件下,将1mol SO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数 | |
| D. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取150kg的食盐 | B. | 用pH试纸测得某溶液的pH为6.72 | ||
| C. | 用普通温度计测得室温为34.68℃ | D. | 用10mL量筒量取7.5mL水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com