

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
分析 β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量浓硫酸溶解β-锂辉矿,加入碳酸钙除去过量的硫酸调节溶液PH=5,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂,
(1)根据元素的化合价将Li、Al、Si写成氧化物形式,中间用•连接即可;
(2)根据工艺流程可知,加入碳酸钙目的是除去硫酸,调节溶液pH,除去铁离子、铝离子;
(3)反应Ⅲ要除去镁离子,加入过量氢氧化钙后生成氢氧化镁沉淀,然后用碳酸钠除去过量的钙离子杂质,所以沉淀为氢氧化镁、碳酸钙;
(4)分离出不溶物方法为过滤;根据表中数据可知,Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)根据蒸干LiCl溶液时,LiCl有少量水解生成LiOH,氢氧化锂部分分解生成氧化锂,电解时会生成氢气.
解答 解:β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量浓硫酸溶解β-锂辉矿,加入碳酸钙除去过量的硫酸调节溶液PH=5,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂,
(1)将硅酸盐改为氧化物形式的方法为:依次将各元素写成氧化物形式,中间用“•”连接,同时要注意氧化物先后顺序,为Li2O•Al2O3•4SiO2,
故答案为:Li2O•Al2O3•4SiO2;
(2)由(1)改写可知,β-锂辉矿在加入过量浓硫酸后,只有SiO2不溶,同时Fe2+被氧化为Fe3+,并生成CaSO4沉淀,所以溶液中含有Fe3+、Al3+、Mg2+、Li+等离子,依据实验目的可知必须除去杂质离子,故在反应Ⅱ中加入碳酸钙的作用为:除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀,
故答案为:除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀;
(3)利用题干信息知反应Ⅲ要除去Mg2+,但在加入沉淀剂Ca(OH)2时会引入大量Ca2+,故还需加入Na2CO3除去Ca2+,即沉淀A为Mg(OH)2沉淀与CaCO3沉淀的混合物,
故答案为:Mg(OH)2、CaCO3;
(4)实验室里分离固液混合物的操作是过滤,由题中给出Li2CO3的溶解度与温度的关系,可知洗涤Li2CO3沉淀要使用热水,
故答案为:过滤;热水;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)由有氧气产生可逆推知可能的原因:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,
故答案为:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2(其他合理答案均可).
点评 本题考查了工业上以β-锂辉矿制取金属锂的方法,题目难度中等,试题涉及了化学式的书写、物质的分离与提纯、离子方程式的书写等知识,合理分析题中工艺流程是解题关键.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
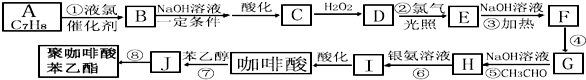
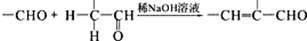 ;
; 
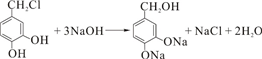 .
.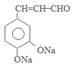 +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$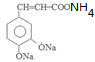 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. (任三种).
(任三种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c>b>d>a | B. | b>a>d>c | C. | a>d>b>c | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸(乙酸钠、水):加入硫酸,后结晶、过滤 | |
| B. | 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,后分液 | |
| C. | 苯(苯酚):加入浓溴水,后过滤 | |
| D. | 氢氧化铁胶体(FeCl3):渗析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吉祥物福娃的材质之一是PVC(聚氯乙烯),其单体的结构简式为CH2=CHCl | |
| B. | “祥云”火炬的燃料为丙烷,分子中三个碳原子共面 | |
| C. | 奥运会上使用了锂电池为奥运村、媒体等处服务,这种高能电池的显著特点是提供相同的电量所需的金属正极质量最小 | |
| D. | 奥运“金镶玉”奖牌中的玉的化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2,它可用氧化物表示为2CaO•5MgO•8SiO2•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0项 | B. | 1项 | C. | 2项 | D. | 3项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com