
 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )| A. | 金属性,甲>乙>丁 | |
| B. | 原子半径,辛>戊>甲 | |
| C. | 形成的最简单氢化物的稳定性,己>戊 | |
| D. | 丙与庚的元素原子核外电子数相差13 |
分析 戊的一种单质是自然界硬度最大的物质,则戊为C元素;甲与戊的原子序数相差3,则甲的原子序数为6-3=3,甲为Li元素;由元素在周期表中的相对位置图可知,乙为Na、丙为K、丁为Ca;丁与辛属同周期元素,由第ⅣA族元素可知,己为Si、庚为Ge、辛为Ga,然后结合元素周期律及元素化合物知识来解答.
解答 解:戊的一种单质是自然界硬度最大的物质,则戊为C,甲与戊的原子序数相差3,则甲的原子序数为6-3=3,即甲为Li,由元素在周期表中的相对位置图可知,乙为Na,丙为K,丁为Ca;丁与辛属同周期元素,由第ⅣA族元素可知,己为Si,庚为Ge,辛为Ga.
A.同主族从上到下金属性增强,由金属活动顺序表可知Ca的金属性比Na强,则金属性甲<乙<丁,故A错误;
B.电子层越多原子半径越大、同主族从上到下原子半径增大,同周期自左而右原子半径减小,则原子半径为辛>甲>戊,故B错误;
C.非金属性越强,对应氢化物稳定性越强,非金属性:己<戊,形成简单氢化物的稳定性:己<戊,故C错误;
D.原子序数等于核外电子数,丙(原子序数为19)与庚(原子序数为32)的原子核外电子数相差32-19=13,故D正确;
故选D.
点评 本题考查位置结构性质的关系,题目难度中等,根据金刚石的硬度及甲与戊的原子序数关系推断各元素为解答的关键,选项A中注意根据金属活动顺序表判断Ca的金属性比Na强.


科目:高中化学 来源: 题型:选择题
| A. | 碱金属在空气中加热均可生成多种氧化物 | |
| B. | 碱金属与水反应,均浮在水面上. | |
| C. | 卤素各单质都能和水剧烈反应. | |
| D. | 卤素单质越活泼,其熔沸点就越低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO | |
| B. | 向FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 三氯化铝溶液与足量的氨水反应:Al3++4OH-=[Al(OH)4]- | |
| D. | 用三氯化铁溶液腐蚀铜印刷电路板:2Fe3++Cu=Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “地沟油”禁止食用,但可用来制肥皂 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 医疗中常用酒精來消毒,是因为酒精能使细菌蛋白质发生变性 | |
| D. | 氨基酸既能和强酸反应,又能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol/L氨水 | B. | 4mol/L HNO3 | C. | 8mol/L NaOH | D. | 18mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
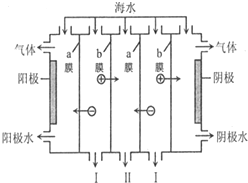
| A. | 阳极可发生电极反应:2Cl--2e-═Cl2↑ | |
| B. | 阴极附近溶液的pH减小 | |
| C. | a膜为阴离子交换膜,b膜为阳离子交换膜 | |
| D. | I、II分别是淡水、浓海水出口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在:Ca2+,Cl-,SO42-,K+ | |
| B. | 弱酸性溶液中可能大量存在:Cu2+,NH4+,NO3-,Cl- | |
| C. | 使石蕊试液变蓝的溶液中可能大量存在:Na+,Al3+,SO42-,NO3- | |
| D. | 水电离的c(OH-)=10-10mol/L溶液中可能大量存在:l-,NO3-,Mg2+,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com