
| A. | 若反应时形成新化学键释放的能量大于断裂旧化学键所吸收的能量,则该化学反应是释放能量的反应 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 化学反应必然伴随着能量的变化 |
分析 A、依据反应实质分析,反应的焓变=断裂化学键吸收的热能量-形成化学键放出的能量分析判断;
B、依据反应前后能量守恒分析判断;
C、化学反应中的能量变化与物质的量的多少有关,焓变的值和化学方程式的书写有关;
D、化学反应过程中一定伴随能量变化,化学反应的实质是化学键的断裂与形成.
解答 解:A、反应的焓变=断裂化学键吸收的热能量-形成化学键放出的能量,若形成化学键释放的能量大于断裂化学键所吸收的能量,△H<0,则反应是放热反应,故A正确;
B、反应前后能量守恒,若反应物的总能量大于生成物的总能量,则反应是放热反应,故B正确;
C、化学反应中能量变化的大小与反应物的质量多少有关,故C错误;
D、化学反应过程中一定伴随能量变化,化学反应的实质是化学键的断裂与形成,所以化学反应必然伴随着能量的变化和化学键的变化,故D正确;
故选C.
点评 本题考查了化学反应的实质应用,反应过程中的能量变化分析,焓变的大小与物质的聚集状态和物质的量有关,题目较简单.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→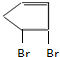 、
、 +Br2→
+Br2→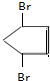 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
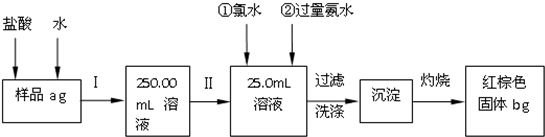
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com