
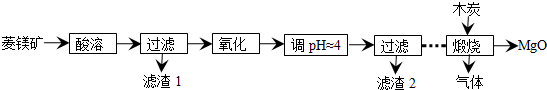
���� ���̿��м���ϡ���ᣬ�����ķ�ӦΪMgCO3+H2SO4=MgSO4+CO2��+H2O��FeCO3+H2SO4=FeSO4+H2O+CO2����Ȼ����˵õ�����1����Һ������Һ�м�����������Fe2+����������Fe3+���Ҳ��������µ����ʣ����������ij�����������˫��ˮ�����������ӷ�Ӧ����ʽΪ2 Fe2++H2O2+2H+=2Fe3++2H2O��������Һ��pHΪ4���ң�Fe3+ת��ΪFe��OH��3��Mg2+��������Һ�У�Ȼ����˵õ�����2ΪFe��OH��3������Һ�о���һϵ�в�������ľ̿���յõ�MgO�����壬���ݣ�4����֪�����ɵ�������S������SO2��CO2��CO��
��1��MgCO3��H2SO4�������ֽⷴӦ����MgSO4��H2O��CO2�����ݷ�Ӧ�����������д����ʽ��
��2���������������������������ת��Ϊ�������Ҳ��������µ����ʣ�
��3��ͨ�����Ϸ���֪������2��Fe��OH��3����Һ��pH=4������Һ��c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L������Һ��c��Fe3+����10-5 mol/LʱFe3+��ȫ�������ݴ˼���Ksp[Fe��OH��3]��
��4�������չ���ҩƷ����������������Ҫ���������Ͻ��м��ȣ�
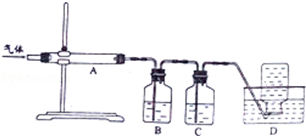
�����յõ���������Ҫ��SO2��CO2��CO��S��������������зֲ����ջ��ռ�������ͨ��Aʹ������������������ͨ��Bװ�ø��������Һ����SO2��ͨ��C�е�����������Һ����CO2�����ʣ��CO������D���ռ���
��B��Һ��Ŀ��������SO2����������CO2�����Ըô���ҺӦ�þ���ǿ�����ԣ��ܺ�SO2��Ӧ�����ܲ����µ����ʣ�
��������ԭ��Ӧ���л��ϼ����ߵ�����Ҳ�л��ϼ۽��͵����ʣ�������Ԫ�����̬Ϊ+4��NaOHû�������ԣ�����ֻ����S�����绯��Ӧ��SԪ�ػ��ϼ۽���Ϊ-2�ۣ����Ը����ӷ�Ӧ������S2-��SO32-��
��� �⣺���̿��м���ϡ���ᣬ�����ķ�ӦΪMgCO3+H2SO4=MgSO4+CO2��+H2O��FeCO3+H2SO4=FeSO4+H2O+CO2����Ȼ����˵õ�����1����Һ������Һ�м�����������Fe2+����������Fe3+���Ҳ��������µ����ʣ����������ij�����������˫��ˮ�����������ӷ�Ӧ����ʽΪ2 Fe2++H2O2+2H+=2Fe3++2H2O��������Һ��pHΪ4���ң�Fe3+ת��ΪFe��OH��3��Mg2+��������Һ�У�Ȼ����˵õ�����2ΪFe��OH��3������Һ�о���һϵ�в�������ľ̿���յõ�MgO�����壬���ݣ�4����֪�����ɵ�������S������SO2��CO2��CO��
��1��MgCO3��H2SO4�������ֽⷴӦ����MgSO4��H2O��CO2�����ݷ�Ӧ�����������д����ʽΪMgCO3+H2SO4�TMgSO4+H2O+CO2�����ʴ�Ϊ��MgCO3+H2SO4�TMgSO4+H2O+CO2����
��2���������������������������ת��Ϊ�������Ҳ��������µ����ʣ����Լ������������H2O2���ʴ�Ϊ��H2O2��
��3��ͨ�����Ϸ���֪������2��Fe��OH��3����Һ��pH=4������Һ��c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L������Һ��c��Fe3+����10-5 mol/LʱFe3+��ȫ������Ksp[Fe��OH��3]=c��OH-��3��c��Fe3+��=��10-10��3.10-5=1��10-35��
�ʴ�Ϊ��Fe��OH��3��1��10-35��
��4�������չ���ҩƷ����������������Ҫ���������Ͻ��м��ȣ����Ի���Ҫ�������������������ǣ���ѡBC��
�����յõ���������Ҫ��SO2��CO2��CO��S��������������зֲ����ջ��ռ�������ͨ��Aʹ������������������ͨ��Bװ�ø��������Һ����SO2��ͨ��C�е�����������Һ����CO2�����ʣ��CO������D���ռ����ʴ�Ϊ��CO��
��B��Һ��Ŀ��������SO2����������CO2�����Ըô���ҺӦ�þ���ǿ�����ԣ��ܺ�SO2��Ӧ�����ܲ����µ����ʣ�
a��NaOH��Һ�����ն�����̼����û��ǿ�����ԣ��������������ʴ���
b��Na2CO3��Һ�����ն�����̼����û��ǿ�����ԣ��������������ʴ���
c��ϡ�������ǿ�����ԣ����������ն������ʴ���
d��KMnO4��Һ����ǿ�����ԣ��������ն���������ȷ��
��ѡd��
��������ԭ��Ӧ���л��ϼ����ߵ�����Ҳ�л��ϼ۽��͵����ʣ�������Ԫ�����̬Ϊ+4��NaOHû�������ԣ�����ֻ����S�����绯��Ӧ��SԪ�ػ��ϼ۽���Ϊ-2�ۣ����Ը����ӷ�Ӧ������S2-��SO32-�����ݷ�Ӧ��������P��Ӧ����֪�������ӷ�Ӧ����ʽΪ3S+6OH-$\frac{\underline{\;\;��\;\;}}{\;}$2S2-+SO32-+3H2O���ʴ�Ϊ��3S+6OH-$\frac{\underline{\;\;��\;\;}}{\;}$2S2-+SO32-+3H2O��
���� ���⿼�����ʷ�����ᴿ��Ϊ��Ƶ���㣬�漰������ԭ��Ӧ�����ӡ����ʼ��顢������ѡȡ���ܶȻ�������֪ʶ�㣬�ۺ��Խ�ǿ����ȷ��Ӧԭ����������������������;���������ܽ�ƽ��ȼ��ɽ��ע�����ʱҪ��ȥ�����Ҳ��������µ����ʣ��״����ǣ�4�����⣬ע��SO2��CO2�����������Ⱥ�˳�����õ��Լ�����Ŀ�ѶȲ���


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���в����ڶ����ЧӦ�ķ�ɢϵ��
A���г����Ŀ��� B����ˮ
C��ʳ��ˮ D�����ˮ�е���FeCl3������Һ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
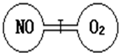 ��ͼ��ʾ��������ͨ�����û����ֿ����������ң������ͬ��������һ����NO��O2����ǡ��ʹ�������������ܶ���ͬ����֪2NO+O2�T2NO2��������ʹNO��O2��ַ�Ӧ��������˵��������ǣ�������
��ͼ��ʾ��������ͨ�����û����ֿ����������ң������ͬ��������һ����NO��O2����ǡ��ʹ�������������ܶ���ͬ����֪2NO+O2�T2NO2��������ʹNO��O2��ַ�Ӧ��������˵��������ǣ�������| A�� | ��ʼʱ�������ҷ�������ͬ | B�� | ��Ӧ��ʼ��NO��ѹǿ��С | ||
| C�� | �����������ܶ���ԭ����ͬ | D�� | ������������Ȼ��O2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
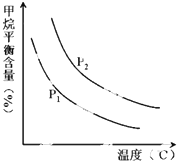 �ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ����
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ����| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
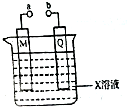
| A�� | ��X��M��Q�ֱ���H2SO4��Pb��PbO2��a��b���Ӻ���������PbSO4���� | |
| B�� | ��X��M��Q�ֱ��ǵμӷ�̪��Na2SO4��C��Fe��a��b�ֱ����ӵ�Դ��������������ͨ���Q��Χ��Һ��ɫ��� | |
| C�� | ��X��M��Q�ֱ�CuSO4��Cu��Fe��a��b�ֱ����ӵ�Դ����������������϶�ͭ | |
| D�� | ��X��M��Q�ֱ���NaCl��C��Fe����a��b���Ӻ�M�缫����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com