
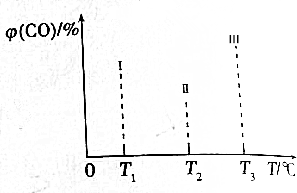
分析 CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小.
解答 解:CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以CO转化率最大的反应温度是T1,
故答案为:Ⅲ;T1.
点评 本题主要考查温度对平衡移动的影响及转化率大小的比较,注意知识的归纳和整理是关键.


科目:高中化学 来源: 题型:选择题
| A. | 10-3mol/L | B. | 10-7 mol/L | C. | 10-11 mol/L | D. | 10-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | |
| (2) | 冬天,居民烧木炭取暖 | |
| (3) | 镁燃烧制照明弹 | |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的最大 | |
| B. | 同主族两种元素原子的核外电子数的差值可能为36 | |
| C. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素的原子 | |
| D. | 科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的 |
| A | 金属甲、乙在氢氧化钠溶液中构成原电池 | 验证甲、乙的活性强弱 |
| B | 用惰性电极电解不同浓度的AgNO3和Cu(NO3)2的混合溶液 | 证明单质铜比银活泼 |
| C | 在氢氧化镁和氢氧化钠溶液中加入氯化铁溶液 | 证明Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| D | 测定0.1mol•L-1Na2X、0.1mol•L-1Na2Y溶液的pH | 验证H2X和H2Y酸性的相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
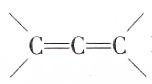 不稳定).
不稳定).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com