
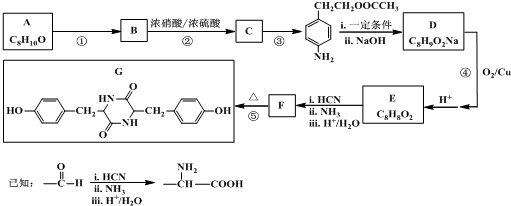
 ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为 ,D发生催化氧化,再酸化得到E,结合E的结构与反应③产物的结构可知D为
,D发生催化氧化,再酸化得到E,结合E的结构与反应③产物的结构可知D为 ,据此解答.
,据此解答. ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为 ,D发生催化氧化,再酸化得到E,结合E的结构与反应③产物的结构可知D为
,D发生催化氧化,再酸化得到E,结合E的结构与反应③产物的结构可知D为 ,
, ,有6种化学环境不同的氢原子,核磁共振氢谱有6个吸收峰,故答案为:羟基、肽键;6;
,有6种化学环境不同的氢原子,核磁共振氢谱有6个吸收峰,故答案为:羟基、肽键;6; ,名称为苯乙醇,F的结构简式为
,名称为苯乙醇,F的结构简式为 ,故答案为:苯乙醇;
,故答案为:苯乙醇; ;
; ,故答案为:
,故答案为: ;
; )有多种同分异构体,同时满足下列条件的同分异构体:①属于α-氨基酸,且苯环上有三个互为间位的取代基;②与FeCl3溶液作用无显色现象,没有酚羟基;③1mol该同分异构体与足量氢氧化钠溶液反应时,最多能消耗3molNaOH,还含有羧酸与酚形成的酯基,结合C的分子式可知,符合条件的同分异构体为
)有多种同分异构体,同时满足下列条件的同分异构体:①属于α-氨基酸,且苯环上有三个互为间位的取代基;②与FeCl3溶液作用无显色现象,没有酚羟基;③1mol该同分异构体与足量氢氧化钠溶液反应时,最多能消耗3molNaOH,还含有羧酸与酚形成的酯基,结合C的分子式可知,符合条件的同分异构体为 ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
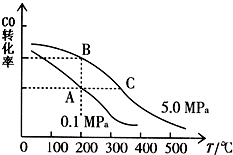 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取11.7 g CuO粉末 |
| B、用广泛的pH试纸测得溶液的pH为6.2 |
| C、温度计显示的室温读数为25.69℃ |
| D、用100 mL量筒量取5.6 mL的稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
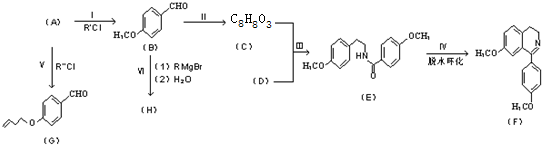
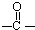 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应: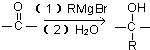
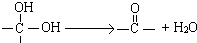
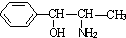 )互为同分异构体
)互为同分异构体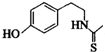 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式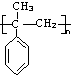 的合成路线流程图:
的合成路线流程图: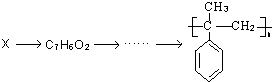
| HBr |
| N2OH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
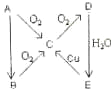 A、B、C、D、E、在一定条件下的转换条件如图所示:
A、B、C、D、E、在一定条件下的转换条件如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com