
 2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.| 1 |
| 2 |
| △c(N2) |
| △t |
| 1.0mol/L |
| 5min |
| c2(NO) |
| c(N2)c(O2) |
| (2.0mol)2 |
| 1.0mol×2.0mol |
| c2(NO) |
| c(N2)c(O2) |
| (2.0mol)2 |
| 1.0mol×2.0mol |
| m |
| V |
| 1 |
| 2 |
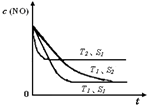 ,
, .
.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目增加,导电性增强 |
| B、醋酸的电离程度增大,[H+]减小 |
| C、再加入10mL pH=11 NaOH溶液,混合液pH=7 |
| D、溶液中由水电离出的[H+]=1×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列反应前后物质的总能量变化可用如图表示的是( )
下列反应前后物质的总能量变化可用如图表示的是( )| A、H-F═H+F |
| B、生石灰加水生成熟石灰 |
| C、金属钠与水反应 |
| D、HNO3+NaOH=NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇,
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇,查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,在容器A、B中分别装有20℃的水50mL,试管C、D相连通,其中存在下列平衡:2NO2(g)?N2O4(g)△H=-57kJ/mol;当向A中加入2g苛性钠时:
如图所示,在容器A、B中分别装有20℃的水50mL,试管C、D相连通,其中存在下列平衡:2NO2(g)?N2O4(g)△H=-57kJ/mol;当向A中加入2g苛性钠时:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com