
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)分析 (1)含氧酸都可写成(HO)m ROn形式,n值越大,酸性越强;
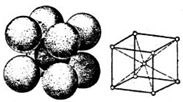
(2)甲烷晶胞结构是面心立方结构,与一个甲烷分子紧密相邻的甲烷分子个数=3×8÷2;
(3)金属阳离子含未成对电子越多,则磁性越大,根据离子的最外层电子数判断未成对电子;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子;原子晶体熔沸点的高低取决于共价键的稳定性;
(5)空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,晶胞中铁位于晶胞的顶点和体心,晶胞平均含有8×$\frac{1}{8}$+1=2个铁原子,根据ρ=$\frac{m}{V}$计算体积,根据体积计算边长,根据边长计算铁原子半径.
解答 解:(1)①H3PO4可写成(HO)3PO,n=1,
②HClO可写成(HO)1Cl,n=0,
③H3BO3可写成(HO)1B,n=0,
④HNO2可写成(HO)NO,n=1,
所以H3PO4、HNO2酸性相近,HClO和H3BO3酸性相近,
故答案为:①;④;②;③;
(2)甲烷晶胞结构是面心立方结构,与一个甲烷分子紧密相邻的甲烷分子个数=3×8÷2=12,
故答案为:12;
(3)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,为成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子,两者都是原子晶体,结构和组成相似,Si-C键长大于C-C键长,C-Si键能小,所以金刚石晶体的熔沸点高于碳化硅,
故答案为:6;金刚石;两者都是原子晶体,C-C键长短,键能大,所以金刚石熔点高于碳化硅;
(5)晶胞中铁位于晶胞的顶点和体心,晶胞平均含有8×$\frac{1}{8}$+1=2个铁原子,设晶胞边长为x,则铁原子半径为$\frac{\sqrt{3}}{4}$x,其空间利用率为$\frac{晶胞所含原子体积}{晶胞体积}$×100%=$\frac{2×\frac{4}{3}π(\frac{\sqrt{3}}{4}x)^{3}}{{x}^{3}}$×100%=68%,金属铁的密度为dg•cm-3,铁的相对原子质量是56,则有d=$\frac{\frac{2M}{{N}_{A}}}{{x}^{3}}$,x=$\root{3}{\frac{112}{{N}_{A}d}}$cm,所以铁原子为$\frac{\sqrt{3}}{4}$$\root{3}{\frac{112}{{N}_{A}d}}$cm,
故答案为:68%;$\frac{\sqrt{3}}{4}$$\root{3}{\frac{112}{{N}_{A}d}}$.
点评 题考查物质结构和性质,涉及物质的性质、分子空间构型、金属晶体的结构及计算,难度中等,解题时要注意基础知识的运用,要熟记常见晶胞的结构和空间利用率.


科目:高中化学 来源: 题型:解答题
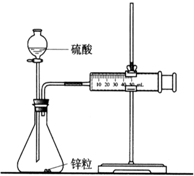 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
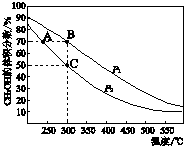 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,只伴随着热量的变化 | |
| B. | 物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生 | |
| C. | 太阳能、氢能、生物质能属于新能源 | |
| D. | 化石燃料是一次能源,乙醇是不可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-=3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一=2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4<HBrO4<HClO4 | B. | 原子半径大小:Na>O>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
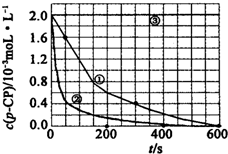 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):| 实验序号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照物 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 10 | 6.0 | 0.30 | |
| c(I-)/(mol•L-1) | c(Fe3+)/(mol•L-1) | v/(mol•L-1•s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com