
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
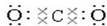 ,O=C=O.
,O=C=O.分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)由上述分析可知元素;
(2)①、③两种元素形成的化合物有一氧化碳、二氧化碳;
(3)①元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对;
(4)由于氟元素没有最高价含氧酸,故上述元素中Cl元素的最高价氧化物的对应水化物高氯酸的酸性最强;上述元素中Na的金属性最强,故氢氧化钠碱性最强;氢氧化铝为具有两性.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)②⑧⑩三种元素分别为N、Si、S,故答案为:N;Si;S;
(2)①、③两种元素形成的化合物有一氧化碳、二氧化碳,化学式分别为CO、CO2,故答案为:CO;CO2;
(3)①元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为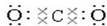 ,结构式为O=C=O,
,结构式为O=C=O,
故答案为: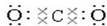 :O=C=O;
:O=C=O;
(4)由于氟元素没有最高价含氧酸,故上述元素中Cl元素的最高价氧化物的对应水化物--高氯酸的酸性最强,高氯酸化学式为HClO4;上述元素中Na的金属性最强,故氢氧化钠碱性最强,其化学式为NaOH,能形成两性氢氧化物的元素是Al,
故答案为:HClO4;NaOH;Al.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液不显红色.再向溶液中加入几滴新制氯水,溶液变为红色. | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入到品红溶液中,品红褪色 | 该气体一定为SO2 |
| D | 向某溶液中滴入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl属于离子化合物 | B. | 原子团为OH-属于羟基 | ||
| C. | 乙醇与水混合后静置,不出现分层 | D. | 淀粉水解的最终产物含有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
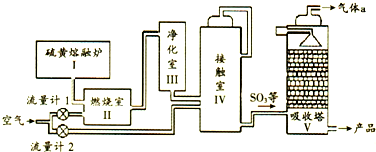
| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com