
��15�֣�A��B��C��D��E�����ֶ����ڵ�����Ԫ�أ����ǵ�ԭ��������������A��D������C��ԭ�Ӹ�����Ϊ1:1��2:1�γɻ����A��B��ɵ���̬�������ˮ��Һ�ʼ��ԣ�E��C��������������ͬ��
��1������D��ԭ�ӽṹʾ��ͼ ��EԪ�������ڱ��е�λ���� ��
��2��A��C�γ�ԭ�Ӹ�����Ϊ1:1�Ļ�����ף����к��л�ѧ������Ϊ ��
��3��D��C��ԭ�Ӹ�����Ϊ1:1�γɻ�����ĵ���ʽ�� ��
��4��B��C���γ��⻯����ȶ�����ǿ������˳���� (�����Ļ�ѧʽ)��
��5��F��һ����ʷ�ƾá�Ӧ�ù㷺�Ľ���Ԫ�ء�����F����Ͷ�뵽������Һ�У�������dz��ɫ��ҺM��д��M��������Һ��A�� C�γɵĻ������Ӧ�����ӷ���ʽ ��
��6����������Ѱ����ʵĴ����͵缫���ϣ���A2��B2Ϊ�缫��Ӧ���HCl��NH4Cl��ҺΪ�������Һ��������ȼ�ϵ�أ���д���õ�ص������缫��Ӧʽ�� ���ŵ�ʱ��Һ��H+���� �����������������
��7�� E(s)+O2(g) EO2(g) ��H1 E(g)+O2(g) EO2(g) ��H2��
���Hl ��H2���>����<����=������
��1��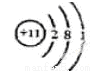 ��1�֣� ��3���ڵڢ�A�壨1�֣�
��1�֣� ��3���ڵڢ�A�壨1�֣�
��2�����ۼ� ��1�֣� ��3��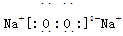 ��2�֣�
��2�֣�
��4��H2O��NH3 ��2�֣� ��5�� 2Fe2++H2O2+2H+=2Fe3++2H2O��2�֣�
��6��N2+6e-+8H+=2NH4+ ��2�֣� ����2�֣� ��7�� >��2�֣�
��������
�����������������֪��A��B��ɵ���̬�������ˮ��Һ�ʼ��ԣ���A��HԪ�أ�B��NԪ�أ������γɵĻ������ǰ�����ˮ��Һ�ʼ��ԣ�A��D������C��ԭ�Ӹ�����Ϊ1:1��2:1�γɻ������D��Na��C��O���γɵĻ�����������������������ԭ�Ӹ�����Ϊ1:1��2:1��E��C��������������ͬ����E��SԪ�ء���1��DΪ��Ԫ�أ�ԭ�ӽṹʾ��ͼΪ
 ��
��
EΪ��Ԫ�أ������ڱ��е�λ���ǵ�3���ڵڢ�A�壻��2��A��C�γ�ԭ�Ӹ�����Ϊ1:1�Ļ�������ǹ������⣬��ѧ�������ǹ��ۼ�����3��D��C��ԭ�Ӹ�����Ϊ1:1�γɻ������ǹ������ƣ��������ӻ��������ʽΪ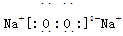 ����4��N�ķǽ����Ա�O��������B��C���γ��⻯��ˮ���ȶ��Դ��ڰ������ȶ�����ǿ������˳����H2O��NH3����5��F����Ͷ�뵽������Һ�У�������dz��ɫ��ҺM����M���Ȼ�������F��Fe���Ȼ�������������������������·���������ԭ��Ӧ�����������Ӻ�ˮ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++H2O����6��������������Ϊԭ�ϵĵ�ص������ǵ���������ԭ��Ӧ����ϵ������Һ�����õ����������ӽ������笠����ӣ��缫��ӦʽΪN2+6e-+8H+=2NH4+��ԭ����е��������������������Էŵ�ʱ��Һ��H+������������7�������ۻ�ΪҺ����Ҫ���ȣ�������̬S��ȫȼ�շų��������࣬���Hl>��H2��
����4��N�ķǽ����Ա�O��������B��C���γ��⻯��ˮ���ȶ��Դ��ڰ������ȶ�����ǿ������˳����H2O��NH3����5��F����Ͷ�뵽������Һ�У�������dz��ɫ��ҺM����M���Ȼ�������F��Fe���Ȼ�������������������������·���������ԭ��Ӧ�����������Ӻ�ˮ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++H2O����6��������������Ϊԭ�ϵĵ�ص������ǵ���������ԭ��Ӧ����ϵ������Һ�����õ����������ӽ������笠����ӣ��缫��ӦʽΪN2+6e-+8H+=2NH4+��ԭ����е��������������������Էŵ�ʱ��Һ��H+������������7�������ۻ�ΪҺ����Ҫ���ȣ�������̬S��ȫȼ�շų��������࣬���Hl>��H2��
���㣺����Ԫ�ص��жϣ�Ԫ�ؼ��仯���������Ӧ�ã��绯ѧ��Ӧԭ������ЧӦ���ж�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�����¿���10�£���ѧ�Ծ��������棩 ���ͣ�ѡ����
������һ��Ԫ�ص�ԭ�Ӽ䷴Ӧ�����γ����Ӽ�
ԭ�� | a | b | c | d | e | f | g |
M������� | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A��a��c B��c��g C��e��g D��b��g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ��Ϫ�С���Ҧ�и�����ѧ������������ѧ�Ծ��������棩 ���ͣ������
��10�֣������к��зḻ�ġ���������ʽ���ڵĵ�Ԫ�أ���ͼ��ʵ���ҴӺ�������ȡ������̵�һ���֡�
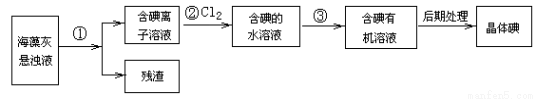
�ش��������⣺
��1������١��۵IJ����ֱ��� ��
��2������ڵ����ӷ�Ӧ����ʽ�� ���������Cl2Ӧ �����������������������
��3���ڲ������������Cl2�������������������ѡ�ã�����ţ��� ��
A��Ũ���� B��������ˮ C�����������Һ D��˫��ˮ
��4���������Ӧ������л��ܼ��� ���������� ���л��ܼ���
��5���ܷ��õ�����Һ���鲽��ڵķ�Ӧ�з������ȫ �����ܻ���������ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ��Ϫ�С���Ҧ�и�����ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ��Ӧ�����ڼӳɷ�Ӧ����
A��CH2=CH2+HBr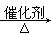 CH3CH2Br
CH3CH2Br
B��
C��2CH3CH2OH+O2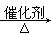 2CH3CHO+2H2O
2CH3CHO+2H2O
D��CH4+2Cl2 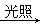 CH2Cl2+2HCl
CH2Cl2+2HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ��Ϫ�С���Ҧ�и�����ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�㶫�غ������ڶ��쳣���ִ�����������ʹ���ٹ�·�رգ�����ͣ�ɡ����������з�ɢϵ�е�
A������ B ����Һ C������Һ D����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڵڶ���������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��25��ʱ��pH=7��NH4Cl��NH3��H2O�����Һ��c(H+)= c(OH��)= c(NH4��+)=c(Cl��)
B��0.1mol/LNa2S��Һ��c(OH��)=c(H+)+c(HS��)+c(H2S)
C��25��ʱ��pH=2��HCOOH��pH=12��NaOH�������ϣ�c(HCOO��)+ c(H+)>c(Na+)+c(OH��)
D��0.1mol/LNa2CO3��Һ��0.1mol/L NaHCO3��Һ�������ϣ�2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڵڶ���������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A���ڷ�ӦKIO3 + 6 HI = KI + 3I2 + 3 H2O�У�ÿ����3mo1 I2ת�Ƶĵ�����Ϊ5NA
B�������£�28.0g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����ĿΪ3NA
C����1L0.1mol��L-1̼������Һ�У�����������С��0.1NA
D��1mol Na2O2 �����к���������Ϊ4 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42-��HCO3�������ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵����ȷ����
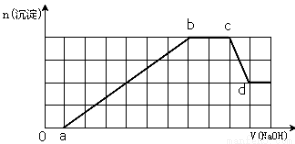
A��ԭ��Һ�к��е�Fe3+��Al3+�����ʵ���֮��Ϊ1:1
B��ab�η��������ӷ�ӦΪ��Al3++3OH��= Al(OH)3����Mg2++2OH��= Mg(OH)2��
C��ԭ��Һ�к��е������ӱض���H+��NH4+��Al3+��Mg2+
D��d����Һ�к��е�����ֻ��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�еġ�H�ܱ�ʾ��ȼ���ȼ���ȵ���
A��2H2S(g)+O2(g)=2S (s)+2H2O(l) ��H=�DQ2 kJ/mol
B��CH4(g)+2O2(g)==CO2(g)+2H2O(g); ��H=��802.3kJ/mol
C��CO(g)+1/2O2(g)==CO2(g); ��H=��283kJ/mol
D��2H2(g)+O2(g)==2H2O��1��; ��H=��571.6kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com