
 如图是制取、干燥和收集某气体的实验装置,可用于( )
如图是制取、干燥和收集某气体的实验装置,可用于( )| A、用Zn与稀H2SO4反应制H2 |
| B、用CaO与浓氨水反应制NH3 |
| C、用Cu与稀HNO3反应制NO |
| D、用MnO2与浓HCl反应制C12 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

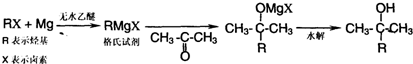
 )为原料,通过以下各步转化,最终可制得有机物
)为原料,通过以下各步转化,最终可制得有机物 (部分反应过程及反应条件略去)
(部分反应过程及反应条件略去)
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质 | B、金属元素 |
| C、金属铜 | D、金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、H+、HCO3-、NO3- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | Agl |
| 溶度积 | 1.4×10-10 | 1.4×10-5 | 6.4×10-50 | 7.7×-13 | 8.51×10-16 |
| A、25℃时五种银盐的饱和溶液中,c(Ag+)最小的是Ag2S溶液 |
| B、25℃时,将Ag2S固体溶解到浓度为0.001mol?L-1的Na2S溶液中达到饱和,此时c(Ag+)=8.0×10-24mol?L-1 |
| C、25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同 |
| D、AgBr沉淀可以转化成Agl沉淀,而Agl沉淀在一定条件下也可以转化成AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
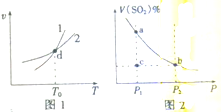 某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应速率(v)与温度(T)、SO2的体积分数[v(SO2)%]与压强(P)的关系分别如图1、图2所示.下列说法不正确的是( )
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应速率(v)与温度(T)、SO2的体积分数[v(SO2)%]与压强(P)的关系分别如图1、图2所示.下列说法不正确的是( )| A、图1中,曲线Ⅰ表示逆反应速率与温度的关系 |
| B、图1中,d点表示温度为T0时,反应已经达到平衡 |
| C、图2中,温度恒定时,a、b两点对应的反应速率:va>vb |
| D、图2中,温度恒定时,c点的反应正在向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com