
【题目】下列物质的水溶液能导电,且属于强电解质的是
A.NH4HCO3 B.Cl2 C.CH3COOH D.SO2
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】某化学电源的工作原理如图。下列说法不正确的是( )
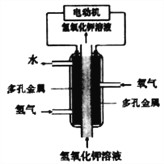
A. 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力
B. 通H2的电极作负极,发生氧化反应
C. 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O
D. 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小李在进行生物组织中化合物的鉴定时,向待测样液中滴加3滴苏丹Ⅲ染液。结果样液被染成橘黄色,说明样液中存在 ( )
A. 还原糖 B. 脂肪 C. 蛋白质 D. DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
酸 | H2C2O4 | HF | H2CO3 | H2BO3 |
电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
①甲同学取一定体积的HF溶液,滴入2滴紫色石蕊试液,显红色,再加入NaF固体观察到的现象是_______________,则证明HF为弱酸。
②乙同学取10ml未知浓度的HF溶液,测其pH为a,然后用蒸馏水稀释至1000ml。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<_________(用含a的代数式表示)。
③丙同学用pH是指测得室温下0.10mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为__________________。
(2)①已知H2BO3与NaOH溶液反应的离子方程式为H2BO3+OH-=B(OH)4,写出硼酸的电离方程式______________。
②向等浓度的H2C2O4与H2BO3混合溶液中逐滴加入NaOH溶液,则与OH-作用的粒子(包括分子和离子)依次为_____________,____________,____________。
③NaH C2O4溶液中加入少量的Na2CO3溶液,反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为500ml的I、II、III三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g) ![]() 2NH3(△H<0)。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
2NH3(△H<0)。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是

A.当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态
B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ
C.在t min时,测得c(N2)=1mol/L;若在向III中充入1.5molN2和1molNH3,H2的转化率不变
D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和④的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号,下同);
(3)⑥的原子结构示意图为_____________;
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与③最高价氧化物的水化物反应的化学方程式:___________________________________;
(5)⑦、⑧的氢化物热稳定性较强的是________(填氢化物化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
组号 | 反应 | Na2S2O3 | H2SO4 | H2O | ||
体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | ||
A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+O2(气) ![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示回答有关问题:

(1)甲池为_________(选填“原电池”或“电解池”),
(2)乙池中Zn棒上发生反应的电极反应式为:____________________.
(3)石墨A上收集到1.12L气体(标况下),则反应过程中转移的电子数为__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com