
【题目】下列物质中含有共价键的离子化合物是( )
A. CO2 B. NaCl C. Na2O2 D. CH4
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
【实验一】配制并标定醋酸溶液的浓度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所稀释的醋酸溶液的浓度进行标定。请回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
则①滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂 D.甲基橙)为指示剂(填字母)
②该醋酸溶液的准确浓度为________(保留小数点后四位)。
【实验二】探究浓度对醋酸电离程度的影响。用pH计测定25 ℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸浓度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度______(填“增大”“减小”或“不变”)。
【实验三】探究温度对醋酸电离程度的影响。
(5)要完成该探究,需要用pH计(或pH试纸)测定 ___________________________。
【醋酸电离的应用】
(6)通过实验测定常温下醋酸的Ka=1×10-5,则0.1 mol·L-1醋酸钠溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为________,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3的沸点比N2O的沸点________(填“高”或“低”),其主要原因是________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为________,与CN—互为等电子体的单质的分子式为_________。HCN分子中σ键和π键的个数之比为________。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为________,若该晶胞边长为acm,则该晶胞密度为________g/cm3。
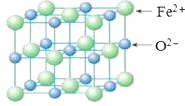
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,小烧杯放在一块沾有水的玻璃片上,加入NH4Cl固体与氢氧化钡晶体[Ba(OH)28H2O],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可推断( ) 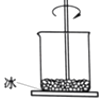
A.该反应中,化学能转变成热能
B.反应物的总能量低于生成物的总能量
C.氯化铵与氢氧化钡的反应为放热反应
D.反应的热化学方程式为:2NH4Cl+Ba(OH)2═BaCl2+2NH3H2O△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关基本营养物质说法正确的是
A.淀粉和纤维素互为同分异构体
B.油脂没有固定的熔沸点
C.葡萄糖、果糖、蔗糖都能发生水解反应
D.糖类、油脂、蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼是一种重要的化工原料。某同学设计的三氯化硼制备装置如下图:

【查阅资料】
①BCl3的熔点为―107.3 ℃,沸点为12.5 ℃
②2B+6HCl![]() 2 BCl3+3H2
2 BCl3+3H2
请回答下列问题:
(1)A装置可用高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为________。
(2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为:_______________
a→(___,___)→(___,___) →(___,___)→(___,___)→j。
(3)装置E中的试剂为_______,如果拆去E装置,可能的后果是 _____________。
(4)D装置中发生反应前先通入一段时间的氯气,其目的是__________,该装置中发生反应的化学方程式为 _________________________。
(5)三氯化硼与水能剧烈反应生成两种酸,写出该反应的化学方程式 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)烧杯间填满碎泡沫塑料的作用是 .
(3)理论上稀的强酸溶液与强碱溶液反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(5)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇和乙酸都是常用调味品的主要成分
B. 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C. 乙醇能发生氧化反应,而乙酸不能发生氧化反应
D. 乙醇和乙酸之间能发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com