
| A. | 容器中可能有固体残渣 | B. | 所得溶液中一定存在Fe2+ | ||
| C. | 反应过程中水的电离程度增大 | D. | 再加入铜后,溶液红色逐渐退去 |
分析 将铜和氧化铁的混和物溶于足量稀盐酸中,发生反应Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2,向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜一定全部溶解;
解答 解:将铜和氧化铁的混和物溶于足量稀盐酸中,发生反应Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2,向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜在溶液中一定全部溶解,生成氯化铜,部分铁元素变化为亚铁盐,
A.氧化铁溶于过量的稀盐酸,生成的氯化铁过量铜全部溶解,容器中不可能有固体残渣,故A错误;
B.向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜在溶液中一定全部溶解,生成氯化铜,部分铁元素变化为亚铁盐,故B正确;
C.氧化铁溶解于盐酸,氢离子浓度减小,生成的氯化铜、氯化亚铁和氯化铁溶液中水解溶液显酸性,对水的电离起到促进作用,反应过程中水的电离程度增大,故C正确;
D.分析可知铁离子过量,向所得溶液中滴入2滴KSCN溶液后出现红色,Fe3++3SCN-?Fe(SCN)3,加入铜发生反应2FeCl3+Cu=2FeCl2+CuCl2,Fe3++3SCN-?Fe(SCN)3,平衡逆向进行,铁离子消失后溶液红色褪去,故D正确;
故选A.
点评 本题考查了铁及其化合物性质的分析应用,主要是反应顺序和反应产物的判断,注意能反应的不能共存,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷分子为正四面体结构 | |
| B. | 2-丁烯分子中4个碳原子不在同一平面内 | |
| C. | 甲苯分子中7个碳原子都在同一平面内 | |
| D. | 丙烷分子中的3个碳原子一定在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(H+)=1×10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
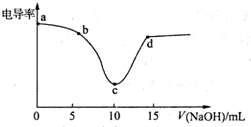 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )
利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒的数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25mL | B. | 17mL | C. | 18mL | D. | 25mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氧氧化钡溶液反应 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 稀硫酸与碳酸钡反应 | D. | 硫酸氢钠溶液与氢氧化坝溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com