
分析 (1)乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为乙烯的质量,根据n=$\frac{m}{M}$计算乙烯的质量,根据n=$\frac{V}{{V}_{m}}$计算混合气体物质的量,进而计算甲烷物质的量,根据m=nM计算甲烷质量;
(2)根据CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O计算消耗氧气物质的量.
解答 解:(1)乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为5.6g,则m(C2H4)=5.6g,n(C2H4)=$\frac{5.6g}{28g/mol}$=0.2mol,而n(CH4)+n(C2H4)=$\frac{11.2L}{22.4L/mol}$=0.5mol,所以n(CH4)=0.5mol-0.2mol=0.3mol,故m(CH4)=0.3mol×16g/mol=4.8g,故原混合气体中甲烷与乙烯的质量之比=4.8g:5.6g=6:7,
答:原混合气体中甲烷与乙烯的质量之比为6:7.
(2)标况下11.2L的混合气体中,甲烷为0.3mol、乙烯为0.2mol,则:
CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O
0.3mol 0.6mol
C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O
0.2mol 0.6mol
故消耗氧气物质的量为0.6mol+0.6mol=1.2mol,
答:消耗氧气的物质的量为1.2mol.
点评 本题考查混合物计算,题目贴近教材,比较基础,关键是明确甲烷与乙烯的性质,熟练掌握基本公式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,若只升高温度,化学平衡正向移动 | |
| B. | 达到平衡后,再通入稀有气体,逆反应速率增大 | |
| C. | 使用催化剂,平衡常数不变 | |
| D. | 0~5 min内,NO的反应速率为2.4×1 0-3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
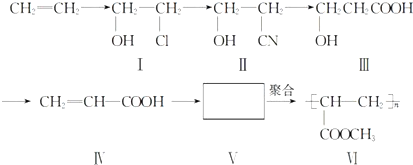
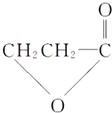 .(提示:该反应的逆反应原子利用率为100%)
.(提示:该反应的逆反应原子利用率为100%)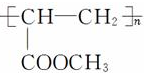 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
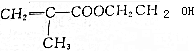 ,下列说法错误的是( )
,下列说法错误的是( )| A. | M能发生加成反应 | |
| B. | M能发生取代反应 | |
| C. | 一定条件下,M能与乙醇发生酯化反应 | |
| D. | M既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有2NA个氢原子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com