
判断溶液的酸碱性有多种方法.下列溶液中,一定呈碱性的是( )
|
| A. | 能够使甲基橙呈现黄色 | B. | 溶液的pH>7 |
|
| C. | 溶液中:c(H+)<c(OH﹣) | D. | 溶液中:c(H+)>1×10﹣7mol•L﹣1 |
考点:
水的电离;盐类水解的应用.
专题:
电离平衡与溶液的pH专题.
分析:
水溶液中都含有氢离子和氢氧根离子,溶液酸碱性取决于氢离子和氢氧根离子的浓度的相对大小:[H+]>[OH﹣]溶液呈酸性;[H+]=[OH﹣]溶液呈中性;[H+]<[OH﹣]溶液呈碱性,室温时,Kw=10﹣14,若溶液中:[H+]=10﹣7,pH值=7,溶液呈中性;[H+]>10﹣7,pH值<7,溶液呈酸性;[H+]<10﹣7,pH值>7,溶液呈碱性,水的电离是吸热过程,升温促进电离程度增大,据此判断.
解答:
解:A.甲基橙变色范围3.1(红)﹣4.4(黄),能使甲基橙呈现黄色的溶液不一定显碱性,故A错误;
B.没指明温度,Kw不一定等于10﹣14,温度不同溶液中离子积不同,不能根据PH大小判断溶液的酸碱性,故B错误;
C.溶液显酸性、中性还是碱性,取决于溶液中c(H+)和c(OH﹣)的相对大小,c(H+)<c(OH﹣),说明溶液一定呈碱性,故C正确;
D.通常情况,Kw等于10﹣14,溶液中:c(H+)>1×10﹣7mol•L﹣1,c(OH﹣)<10﹣7,的溶液,PH<7,溶液显酸性,故D错误;
故选C.
点评:
本题考查溶液的酸碱性和指示剂变色范围,题目难度不大,平时注意知识的积累,注意离子积常数的应用条件恒容溶液酸碱性分析判断.


科目:高中化学 来源: 题型:
“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.下列说法合理的是( )
|
| A. | 依据等电子原理N2O与SiO2分子具有相似的结构(包括电子式) |
|
| B. | 已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示 |
|
| C. | N2O与CO2互为等电子体,因此不含非极性键 |
|
| D. | N2O为三角形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
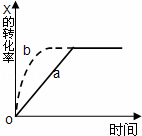
|
| A. | 升高温度 | B. | 加大X的投入量 |
|
| C. | 加催化剂 | D. | 增大体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 电解质在溶液中存在电离平衡状态 |
|
| B. | 电离平衡状态时v结合=v电离=0 |
|
| C. | 弱电解质溶液中,既存在离子也存在分子 |
|
| D. | 电解质的电离是可逆过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH值仍相同,则m和n的关系是( )
|
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。

DEHP(C24H38O4)是增塑剂的一种,可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。
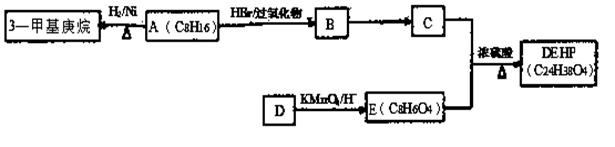
(1)3—甲基庚烷的某同分异构体分子中只存在1种不同化学环境的氢原子,用系统命名法命名为
(2)写出B →C的化学反应方程式,请注明反应条件和反应类型。
B →C: ;反应类型: ;
(3)E的结构简式是 ;DEHP的结构简式是 ;
(4)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液呈紫色; c.能与碳酸氢钠溶液反应。
写出F分子中官能团的名称为_________________________;
(5)G与E形成的混和物,只要物质的量一定,不论二者比例如何,燃烧耗氧是一定值。则满足条件的相对分子质量最小的G的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
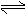 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

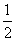 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 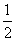 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。
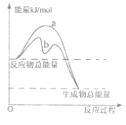
A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
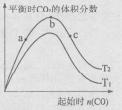
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com