
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
分析 A、先加KSCN溶液不变色,再加氯水变红色可检验Fe2+;
B、氨气可以使红色石蕊试纸变蓝;
C、氯气具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉变蓝;
D、硝酸酸化的硝酸银溶液可以排除其它阴离子的干扰,可以检验原溶液中是否含有氯离子.
解答 解:A、先加KSCN溶液不变色,再加氯水变红色可检验Fe2+,只加KSCN不能验证亚铁离子的存在,故A错误;
B、氨气可以使红色石蕊试纸变蓝,故B正确;
C、氯气具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉变蓝,故C正确;
D、硝酸酸化的硝酸银溶液可以排除其它阴离子对氯离子检验的干扰,可以检验原溶液中是否含有氯离子,故D正确,故选A.
点评 本题主要考查的是常见气体的检验、氯气的性质、HCl气体的制取、物质的分离等,难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
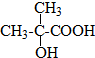 B的结构简式
B的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个丙烯分子有8个σ键,1个π键 | |
| B. | 1、4-二甲苯核磁共振氢谱中有两组峰,且氢原子数之比为3:2 | |
| C. | 丙氨酸分子属于手性分子 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-
H++PO43-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
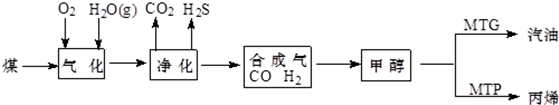
 .
.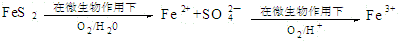
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com