
(14分)某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有___________。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。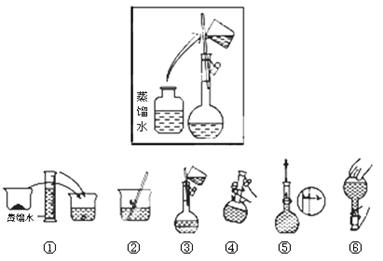
A.②与③ B.①与② C.④与⑤
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
(1)1000mL容量瓶;(2)C; (3)40.0; c;(4)①偏大 ②偏小 ③无影响 ④无影响
(5)NaOH易潮解、易吸收空气中的CO2而变质(答出一点即可); 小 ;
解析试题分析:(1)一定物质的量浓度溶液的配制一定要用到容量瓶。(2)图所示的操作是加入蒸馏水,在移液之后,定容之前,选C(3)容量瓶用的是1000mL容量瓶,所以计算时溶液的体积有1000m,m=c×v×m=1mol/L×1L×40g/mol=40g,加上33.1 g的烧杯总质量为73.31g, 游码位置要移到3.1g的位置,故选C。(4)①定容时,俯视读数造成溶液体积偏大,浓度就偏大;②转移溶液过程中,少量液体溅出来造成溶质有损失,浓度偏小。③定容是要加水,所以没有影响。④摇匀后发现溶液凹面低于刻度线那是分子间所用力造成的,对浓度无影响。
考点:一定物质的量浓度溶液的配制和误差分析。


科目:高中化学 来源: 题型:实验题
15分) 现用98%浓硫酸(密度1.84g/mL)配制100mL1mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒。请回答下列问题:
(1)保存浓硫酸的试剂瓶上除贴B标签外,还需贴上的标签是___________。
(2)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 ,使用之前首先必须进行 。
(3)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL。
(4)稀释时,一定要将 沿器壁慢慢倒入 中并不断搅拌.
(5)下列情况对所配制的稀硫酸浓度有何影响?(填写“偏大”、“偏小”、“无影响”)
| A.所用的浓硫酸长时间放置在密封不好的容器中 |
| B.容量瓶用蒸馏水洗涤后残留有少量的水 |
| C.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| D.定容时俯视溶液的凹液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验室需要0.80mol/LNaOH溶液475mL和0.40mol/L硫酸溶液500mL。根据这两种溶液的配置情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号。)
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,正确的是____________________(填写序号)。
a.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
b.用纸槽往试管里装粉末状药品时,试管应先横放再直立
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在玻璃棒搅拌下慢慢加入浓硫酸
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需用1000mL 0.1 mol/L标准Na2CO3溶液,请回答下列问题
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有 _______ 。
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制1000 mL 0.1 mol·L-1 Na2CO3溶液的实验步骤如下:
a.计算应称取碳酸钠固体的质量为________g。
b.称量碳酸钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的碳酸钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)实验室要用98%(ρ="1.84" g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液400mL
(1)计算所需98%的硫酸 mL
(2)该实验中除了要用到量筒、烧杯以外,还需要用到的玻璃仪器(无需装瓶)有: 、 、 。
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将导致所配制的硫酸溶液浓度偏低的是 。
| A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用量筒量取浓硫酸时,俯视读数 |
| D.容量瓶使用前用3.68mol·L-1硫酸的溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)有二氧化碳与一氧化碳的混合气体共10.8 g,其物质的量为0.3 mol。求:
(1)混合气体中二氧化碳与一氧化碳的物质的量各为多少?
(2)混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
10分)欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:量筒,烧杯,玻璃棒,胶头滴管,________。
(2)现有下列配制操作:
A用量筒量取浓H2SO4 B反复颠倒摇匀 C用胶头滴管加水至刻度
D洗净并干燥所用仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其正确的操作顺序为:___________ 。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL 、20mL、 50mL的量筒,应选用 _____mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取将使配制的浓度_____________(偏高、偏低、无影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com