
分析 (1)Fe位于第四周期第VIII族,高温条件下,氧化铁和CO发生氧化还原反应生成Fe和二氧化碳;
(2)制备Fe(OH)3胶体的步骤是:向沸水中逐滴加入饱和的氯化铁溶液,继续煮沸至溶液变为红褐色即停止加热,即得Fe(OH)3胶体;
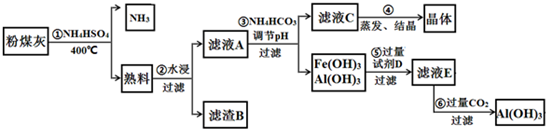
粉煤灰中含有SiO2、Al2O3、Fe2O3等,加入硫酸氢铵加热,第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,则Al2O3、Fe2O3都和硫酸氢铵反应,同时还有氨气生成,得到熟料;熟料水浸后过滤得到滤渣为SiO2,滤液中含有NH4Fe(SO4)2、NH4Al(SO4)2等,向滤液中加入碳酸氢铵调节溶液的pH,过滤,得到氢氧化铝、氢氧化铁沉淀,同时得到滤液C,滤液C中含有硫酸铵,蒸发结晶得到硫酸铵晶体;
氢氧化铝能溶于强碱溶液而氢氧化铁不溶于强碱,所以试剂D为NaOH,得到的滤液中含有偏铝酸钠和NaOH,向滤液E中通入过量二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀;
(3)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,氧化铝和硫酸氢铵反应生成NH4Fe(SO4)2、氨气和水;
在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2属于硫酸盐、复盐,且离子化合物,且为强电解质;
(4)滤渣B的主要成分为二氧化硅,二氧化硅和NaOH溶液反应生成硅酸钠和水;
(5)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,此时c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8;在酸性溶液中,H++HCO3-=H2O+CO2↑;
(6)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合铝酸根离子,第⑥步通入过量二氧化碳生成Al(OH)3.
解答 解:(1)铁在元素周期表中处于第四周期、第VIII族; 赤铁矿的主要成分是Fe2O3,可知赤铁矿与CO反应炼铁的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:第四周期第VIII族;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)制备Fe(OH)3胶体的步骤是:向沸水中逐滴加入饱和的氯化铁溶液,继续煮沸至溶液变为红褐色即停止加热,即得Fe(OH)3胶体,
故答案为:②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③液体呈红褐色;
粉煤灰中含有SiO2、Al2O3、Fe2O3等,加入硫酸氢铵加热,第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,则Al2O3、Fe2O3都和硫酸氢铵反应,同时还有氨气生成,得到熟料;熟料水浸后过滤得到滤渣为SiO2,滤液中含有NH4Fe(SO4)2、NH4Al(SO4)2等,向滤液中加入碳酸氢铵调节溶液的pH,过滤,得到氢氧化铝、氢氧化铁沉淀,同时得到滤液C,滤液C中含有硫酸铵,蒸发结晶得到硫酸铵晶体;
氢氧化铝能溶于强碱溶液而氢氧化铁不溶于强碱,所以试剂D为NaOH,得到的滤液中含有偏铝酸钠和NaOH,向滤液E中通入过量二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀;
(3)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,氧化铝和硫酸氢铵反应生成NH4Fe(SO4)2、氨气和水,反应方程式为Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2 NH4Fe(SO4)2+2NH3↑+3H2O;
在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2属于硫酸盐、复盐,且离子化合物,且为强电解质,所以不属于共价化合物,
故答案为:Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2 NH4Fe(SO4)2+2NH3↑+3H2O;d;
(4)滤渣B的主要成分为SiO2,二氧化硅和NaOH溶液反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2;SiO2+2OH-=SiO32-+H2O;
(5)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,此时c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8,溶液中氢离子浓度=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6 mol/L,则溶液的pH=6,
在酸性溶液中,离子方程式为H++HCO3-=H2O+CO2↑;
故答案为:6;H++HCO3-=H2O+CO2↑;
(6)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合铝酸根离子,第⑥步生成Al(OH)3的离子方程式为[Al(OH)4]-+CO2+H2O=Al(OH)3↓+HCO3-,
故答案为:玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O=Al(OH)3↓+HCO3-.
点评 本题考查化学工业流程,为高频考点,侧重考查学生对流程图整体把握、对元素化合物性质的灵活应用、对基本实验操作掌握,明确元素化合物性质、物质分离提纯方法等知识点是解本题关键,题目难点中等.


科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
标准状况下,向1 00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是

A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | ||
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇是食醋的主要成分 | |
| B. | C2H5OH中C、H、O元素的质量比是2:6:1 | |
| C. | 乙醇不能溶于水 | |
| D. | C2H5OH中C元素的质量分数是$\frac{12×2}{12×2+1×6+16×1}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
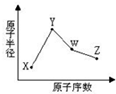 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23Na37Cl中质子数和中子数之比是7:8 | |
| B. | KIO3和NaHSO3都是强电解质 | |
| C. | KIO3作氧化剂发生氧化反应 | |
| D. | 生成1mo1KI时,转移6mo1电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在能与铝置换出氢气的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 常温时,在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com