
| A. | CO2 | B. | N2 | C. | SO2 | D. | CC12F2 |
分析 常见的环境问题有:温室效应、酸雨、臭氧层空洞等,其中CO2能够导致温室效应、SO2是引起酸雨的主要原因、氟利昂是臭氧层空洞的元凶,据此进行解答.
解答 解:A.温室效应的罪魁祸首为二氧化碳气体,与当今地球上重大环境问题相关,故A错误;
B.氮气是空气的组成成分,与环境污染无关,故B正确;
C.二氧化硫是造成酸雨的罪魁祸首,与当今地球上重大环境问题相关,故C错误;
D.氟利昂是臭氧层空洞的元凶,与当今地球上重大环境问题相关,故D错误;
故选B.
点评 本题考查了环境污染的判断,题目难度不大,明确常见的环境污染问题及成因为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
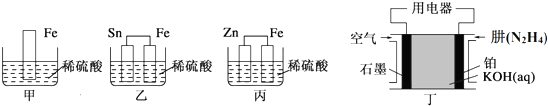
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
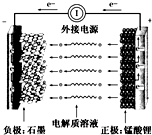 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、酸雨 | C. | HCl、SO2、N2、粉尘 | D. | CO2、NO、NH3、雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
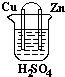
| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每摩尔-CH3中含10NA个电子 | |
| B. | 每摩尔CnH2n+2中,碳原子与碳原子形成的共用电子对数目为nNA | |
| C. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| D. | 每摩尔苯中含有的碳氢单键的数目为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com