
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 起始读数 滴定前 | 终点读数 | ||
| 1 | 20.00 | O.50 | 20.40 |
| 2 | 20.00 | 6.OO | 26.10 |
| 3 | 20.00 | 4.OO | 24.00 |
| 0.0040mol |
| 0.02L |
| 100 |
| 20 |
| 0.80g |
| 0.85g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
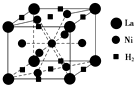 目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
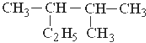 的名称是
的名称是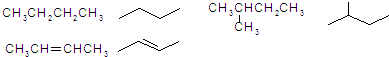
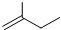
查看答案和解析>>
科目:高中化学 来源: 题型:
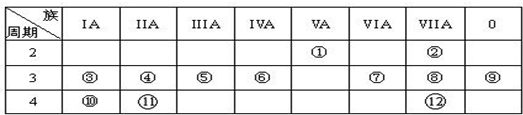
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用盖斯定律可计算某些难以直接测量的反应焓变 |
| B、如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到 |
| C、对于放热反应,放出的热量越多,焓变越小 |
| D、当同一个化学反应以不同的过程完成时,反应的焓变是不同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com