
| A. | 25℃时,pH=2的硫酸与pH=12的Na0H溶液等体积混合溶液显酸性 | |
| B. | 20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,混合溶液中c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1mol/L | |
| C. | 向Na2CO3溶被中通入CO2至溶液为中性,则$\frac{{c(N{a^+})}}{{c(C{O_3}^{2-})}}$>1 | |
| D. | 常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸的电离常数Ka=1.75×10-5) |
分析 A.25℃时,pH=2的硫酸,则溶液中c(H+)=10-2mol/L,pH=12的Na0H溶液,则溶液中c(OH-)=10-2mol/L,二者等体积混合,则溶液中c(H+)=c(OH-);
B.20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,溶液中起始时c(H2A)=0.05mol/L,c(NaOH)=0.05mol/L,根据物料守恒分析;
C.向Na2CO3溶被中通入CO2至溶液为中性,溶液中c(H+)=c(OH-),根据电荷守恒分析;
D.常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),根据醋酸的电离平衡常数分析.
解答 解:A.25℃时,pH=2的硫酸,则溶液中c(H+)=10-2mol/L,pH=12的Na0H溶液,则溶液中c(OH-)=10-2mol/L,二者等体积混合,则溶液中c(H+)=c(OH-),因此溶液显中性,不是酸性,故A错误;
B.20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,溶液中起始时c(H2A)=0.05mol/L,c(NaOH)=0.05mol/L,二者反应恰好生成NaHA,根据物料守恒,c(Na+)=c(HA-)+c(A2-)+c(H2A)=0.05mol/L,故B错误;
C.向Na2CO3溶被中通入CO2至溶液为中性,溶液中c(H+)=c(OH-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),由于c(H+)=c(OH-),则c(Na+)=c(HCO3-)+2c(CO32-),显然c(Na+)>c(CO32-),因此$\frac{c(N{a}^{+})}{c(C{O}_{3}^{2-})}>1$,故C正确;
D.常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),考虑到醋酸存在电离平衡,则溶液中存在关系,Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=c(H+)=1.75×10-5mol/L>10-7mol/L,则溶液显酸性,故D错误.
故选C.
点评 本题考查弱电解质的电离平衡,溶液的酸碱性的判据,离子浓度大小的比较等知识.考查的较为综合,题目难度中等.值得一提的是,D项中,学过大学无机化学的会知道,这是缓冲溶液,可以直接使用公式pH=pKa-lg$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$求解,并且在题述条件时,溶液的缓冲能力是最强的.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证化学反应中的能量变化 | 将NO2球浸泡在冰水,热水中观察颜色变化 |
| B | 证明非金属性:Cl>C>Si | 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中 |
| C | 探究相同条件下,溶液浓度对反应速率的影响 | 在两支试管中各加入4mL 0.01mol/L的KMnO4 酸性溶液,再分别加入0.1mol/L H2C2O4 溶液2mL、0.2mol/L H2C2O4溶液2mL,分别记录溶液褪色所需时间 |
| D | 除去氢氧化铁中少量的氢氧化铜 | 将过量氨水加入混合物中并充分搅拌,然后过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
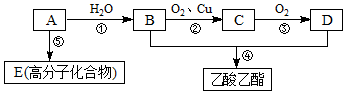
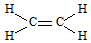 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题




 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 78gNa2O2固体与足量的H2O反应转移的电子数为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 2.0gH218O和D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:
近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com