
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1mol NH4CuSO3完全反应转移0.5mol电子 |
分析 NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应的方程式为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,则NH4CuSO3中Cu的化合价为+1价,以此解答该题.
解答 解:A、由方程式为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,反应只有Cu元素的化合价发生变化,硫酸根反应前后未变,反应中硫酸体现酸性,不作氧化剂,故A错误;
B、NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应前后S元素的化合价没有发生变化,故B错误;
C、因反应是在酸性条件下进行,不可能生成氨气,故C错误;
D、反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,反应的发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,每2molNH4CuSO3参加反应则转移1mol电子,则1molNH4CuSO3完全反应转移0.5mol电子,故D正确.
故选:D.
点评 本题考查氧化还原反应,难度较大,注意从反应现象判断生成物,结合化合价的变化计算电子转移的数目.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
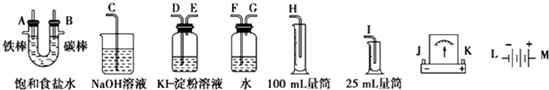
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发:应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 | |
| C. | 分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯 | |
| D. | 量取:用规格为10mL的量筒量取8.0mL液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
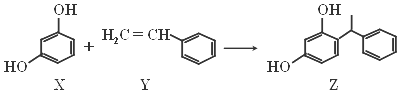
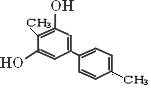
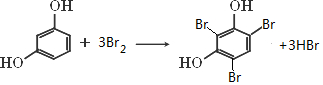
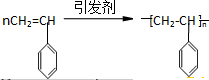
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
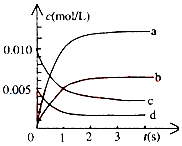 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com