

分析 (1)依据仪器形状说出其名称;容量瓶带有瓶塞,使用过程需要上下颠倒,为防止漏水,应检查是否漏水,分液漏斗带有旋塞,使用过程中需要旋转活塞放液,所以为防止漏液,应检查是否漏水;
(2)a.依据浓硫酸的性质解答;
b.依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
c.依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积.
解答 解:(1)依据图中仪器形状可知:①为蒸馏烧瓶 ②为冷凝管 ③为分液漏斗 ④为100mL容量瓶;容量瓶带有瓶塞,使用过程需要上下颠倒,为防止漏水,应检查是否漏水,分液漏斗带有旋塞,使用过程中需要旋转活塞放液,所以为防止漏液,应检查是否漏水;
故答案为:①蒸馏烧瓶 ②冷凝管 ③分液漏斗 ④100mL容量瓶;③④;
(2)a.浓硫酸具有腐蚀性,D为腐蚀品标志,所以盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的D;
故答案为:D;
b.用浓硫酸配制一定物质的量浓度稀硫酸溶液,一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶;配制制480mL 1mol•L-1的稀硫酸,应选择500mL容量瓶,所以还缺少的仪器:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶、玻璃棒;
c.浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=1mol/L×500mL,解得V=27.2mL;
故答案为:27.2.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格的选择及使用方法,题目难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:实验题
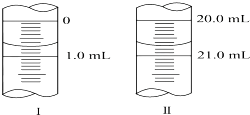 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
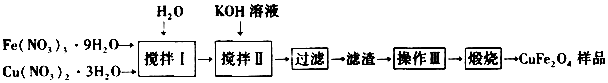
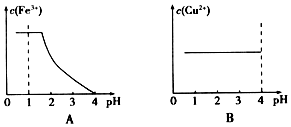
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
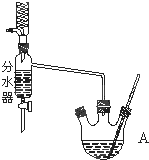 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
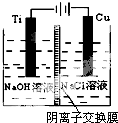 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 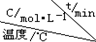 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com