
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lgc(CO)/c(CO2)与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
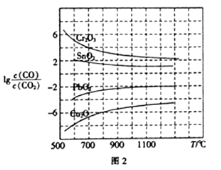
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
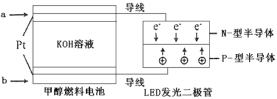
请写出加入(通入)a物质一极的电极反应式___________;每消耗6.4g甲醇转移的电子数为__________。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为_________。
【答案】3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ/mol Ⅲ 0.067 mol/(L·min) BC CH3OH-6e-+8OH—=CO32-+6H2O 1.2NA(或1.2×6.02×1023)
CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ/mol Ⅲ 0.067 mol/(L·min) BC CH3OH-6e-+8OH—=CO32-+6H2O 1.2NA(或1.2×6.02×1023) ![]()
【解析】
(1)根据盖斯定律分析书写CO与H2合成CH3CH=CH2的热化学方程式;
(2)①温度越高反应速率越快,达到平衡状态时,需要的时间越短,据此判断;②利用三段式求出反应生成的甲醇的物质的量浓度,再根据v=![]() 计算;
计算;
(3)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变;B、由图像可知,用CO工业冶炼金属铬时,![]() 一直很高,说明CO转化率很低;C、由图像可知,温度越低,
一直很高,说明CO转化率很低;C、由图像可知,温度越低,![]() 越小,故CO转化率越高;D、CO还原PbO2的反应,达到平衡后升高温度,
越小,故CO转化率越高;D、CO还原PbO2的反应,达到平衡后升高温度,![]() 升高,即升高温度,CO的含量增大,说明平衡逆向移动,据此分析判断;
升高,即升高温度,CO的含量增大,说明平衡逆向移动,据此分析判断;
(4)根据电子的移动方向判断出原电池的正负极,负极上甲醇失去电子生成碳酸钾,根据电子与甲醇的物质的量关系计算;
(5)溶液等体积,混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合电离平衡常数的表达式计算。
(1)①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol,②3CH3OH(g)
CH3OH(g) △H1=-90.1kJ/mol,②3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,根据盖斯定律,将①×3+②得到CO与H2合成CH3CH=CH2的热化学方程式:3CO(g)+6H2(g)
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,根据盖斯定律,将①×3+②得到CO与H2合成CH3CH=CH2的热化学方程式:3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ/mol,故答案为:3CO(g)+6H2(g)
CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ/mol,故答案为:3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ/mol;
(2)①三个容器的反应温度分别为Tl、T2、T3且恒定不变,当反应均进行到5min时H2的体积分数如图1所示,温度越高,反应速率越快,达到平衡需要的时间越短,其中只有一个容器中的反应已经达到平衡状态,最有可能是Ⅲ,平衡后,升高温度,平衡逆向进行,氢气含量最大,故答案为:Ⅲ;
②设反应生成的甲醇为xmol/L,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
开始(mol/L):0.5 1 0
转化(mol/L): x 2x x
平衡(mol/L):0.5-x 1-2x x
到5min时,氢气的体积分数为0.4,则![]() =0.4,解得:x=
=0.4,解得:x=![]() mol/L,容器I中用CH3OH表示的化学反应速率v(CH3OH)=
mol/L,容器I中用CH3OH表示的化学反应速率v(CH3OH)=![]() ═
═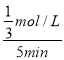 =0.067mol/(Lmin),故答案为:0.067 mol/(Lmin);
=0.067mol/(Lmin),故答案为:0.067 mol/(Lmin);
(3)A.增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;B.由图像可知用CO工业冶炼金属铬时,![]() 一直很高,说明CO转化率很低,故B正确;C.由图像可知温度越低,
一直很高,说明CO转化率很低,故B正确;C.由图像可知温度越低,![]() 越小,故CO转化率越高,工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大,故C正确;D.CO还原PbO2的反应,达到平衡后升高温度,
越小,故CO转化率越高,工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大,故C正确;D.CO还原PbO2的反应,达到平衡后升高温度,![]() 升高,即升高温度,CO的含量增大,说明平衡逆向移动,此反应的△H<0,故D错误;故答案为:BC;
升高,即升高温度,CO的含量增大,说明平衡逆向移动,此反应的△H<0,故D错误;故答案为:BC;
(4)电池反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,该电池负极是甲醇失电子生成碳酸钾,根据图像可知,b电极为正极,电极反应为:O2+4e-+2H2O=4OH-,a为负极,电极反应式为CH3OH-6e-+8OH—=CO32-+6H2O,6.4g甲醇的物质的量为![]() =0.2mol,转移电子的物质的量为0.2mol ×6=1.2mol,即 1.2NA(或1.2×6.02×1023),故答案为:CH3OH-6e-+8OH—=CO32-+6H2O;1.2NA(或1.2×6.02×1023);
=0.2mol,转移电子的物质的量为0.2mol ×6=1.2mol,即 1.2NA(或1.2×6.02×1023),故答案为:CH3OH-6e-+8OH—=CO32-+6H2O;1.2NA(或1.2×6.02×1023);
(5)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液呈中性,根据电荷守恒,2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,溶液中c(H+)=c(OH-)=10-7mol/L,则c(CH3COO-)=2c(Ba2+)=2×![]() mol/L=bmol/L,醋酸电离平衡为CH3COOH
mol/L=bmol/L,醋酸电离平衡为CH3COOH ![]() CH3COO-+H+,则K=
CH3COO-+H+,则K=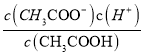 =
=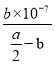 =
=![]() ,故答案为:
,故答案为:![]() 。
。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途,用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
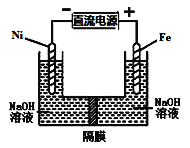
A.镍电极上的电极反应为2H2O+2e-![]() H2↑+2OH-
H2↑+2OH-
B.铁是阳极, 电极反应为Fe-2e-+OH-![]() Fe(OH)2
Fe(OH)2
C.若隔膜为阴离子交换膜, 则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高, 最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
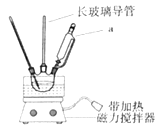
A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是( )
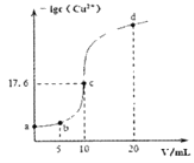
A. 常温下Ksp (CuS)的数量级为10-30
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
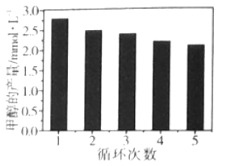
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年获诺贝尔化学奖的是约翰·班尼斯特·古迪纳夫(John B.Goodenough)、迈克尔·斯坦利·威廷汉(M.Stanley Whittlingham)和吉野彰( Akira Yoshino)三位科学家,他们在锂离子电池发展上做出了突出贡献。锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)涂在铝箔上制作而成,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示。下列说法错误的是

LiCoO2+6C=Li1-xCoO2+LixC6
A.石墨加导电剂及黏合剂涂在铜箔基带上作锂离子电池的负极
B.充电时Li+从石墨层状结构中脱嵌,进入电解质
C.放电时的正极反应为Li1-xCoO2+xLi++xe-=LiCoO2
D.锂离子电池常用非水液态有机电解质作电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。

已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________。
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________。

(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________。 pH不能过低的原因是_______________(结合离子方程式说明)。
pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.32g O2所含的原子数目为NA
B.标准状况下,11.2L H2O中含有的原子数目为1.5 NA
C.2L 0.3mol/L的K2SO4溶液中K+离子的物质的量浓度为1.2mol/L
D.常温下,05 NA个氯气分子的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )

A. M的相对分子质量是180
B. 1 mol M最多能与2 mol Br2发生反应
C. M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D. 1 mol M与足量NaHCO3反应能生成2 mol CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com