
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据不同液体混合时体积能否直接加和判断;
D.质量换算物质的量,依据浓度概念计算得到.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误;
C.1L10mol/L的浓盐酸与9L水混合配成溶液的体积不是10L,所以混合后溶液的物质的量浓度不是1mol/L,故C错误;
D.10gNaOH物质的量为0.25mol,溶解后配制为250ml的溶液,其浓度为1 mol•L-1,故D正确.
故选D.
点评 本题考查了溶液浓度的计算应用,主要是溶液混合后体积变化的判断,浓度概念的理解分析,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
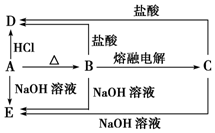 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com