
 ,Li++F-?LiF↓,该反应的平衡常数表达式为K=
,Li++F-?LiF↓,该反应的平衡常数表达式为K=| 1 |
| [c(Li+)?c(F-)] |
 ;
;| 1 |
| [c(Li+)?c(F-)] |
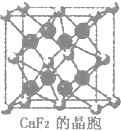 CaF2晶胞中每个Ca2+连接8个氟离子,每个氟离子连4个钙离子,B为K2CO3,反萤石(CaF2)结构,其阴离子做面心立方最密堆积,
CaF2晶胞中每个Ca2+连接8个氟离子,每个氟离子连4个钙离子,B为K2CO3,反萤石(CaF2)结构,其阴离子做面心立方最密堆积,| 19.2g |
| 64g/mol |
| 3 |
| 8 |
| 0.3mol |
| n(H+) |


科目:高中化学 来源: 题型:
| A、7.8g Na2O2所含离子总数为0.4 NA |
| B、2.0gD2O(重水)含有的质子数是NA |
| C、标准状况下,0.5 NA个SO3分子所占的体积约为11.2 L |
| D、4℃时,18mL水分子中所含共价键的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
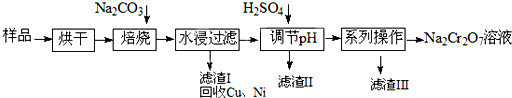
| ||
| 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
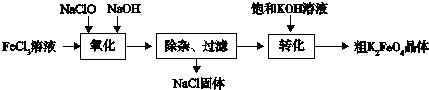
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com