
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A. 研制水溶剂涂料替代有机溶剂涂料
B. 用可降解塑料生产包装盒或快餐盒
C. 用反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O制备硫酸铜
CuSO4+SO2↑+2H2O制备硫酸铜
D. 用反应:2CH2=CH2+O2![]()
![]() 制备环氧乙烷
制备环氧乙烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)-种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al203):2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:

则△H2=____。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的____(填正、负)极,通DME的电极反应为
Ⅱ.2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ/mol(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为

①________________________

(2)T=673K,合成氨反应的热化学方程式为______________
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4C1类似。写出盐酸肼第一步水解反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3—→3
+8HNO3—→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如右图装置的三颈烧瓶中加入16 mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。
请回答下列问题:
(1)装置b的名称为____;滴液漏斗的细支管a的作用是____。
(2)NaOH溶液的作用为____;实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____。
(3)抽滤操作结束时先后进行的操作是______。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或____洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
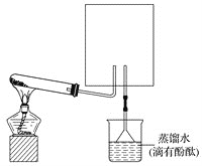
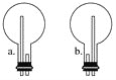
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)调查表明,嘉陵江大桥锈蚀速度每年为0.16mm,远远超过瑞典斯德尔哥尔摩大桥每年0.03mm的锈蚀速率。1982年6月8日,重庆市下了一场大雨,市郊1300多公顷水稻突然枯黄,好像火烧过一样,几天后,局部枯死。上述材料中出现的现象,产生的直接原因是_________________污染问题,在我国,形成该污染的气体主要是_________________。
(2)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应生成CO2和N2。请回答:
① CO与NO反应的化学方程式为_____________________________。
② 控制城市空气污染源的方法可以有_________________(填字母)
a.开发新能源 b.使用电动车 c.植树造林 d.带呼吸面具
(3)垃圾是放错了位置的资源,必须对垃圾进行分类回收。某住宅小区清理出以下垃圾:a.废纸 b.剩菜剩饭、瓜果皮 c.废旧电池 d.废玻璃瓶 e.废橡胶手套 f.一次性塑料饭盒。请用相应的字母填空。
① 其中可投入有![]() 标志垃圾箱的是_________________;
标志垃圾箱的是_________________;
② 其中适宜堆肥处理的垃圾是_________________;
③ 将垃圾按组成材料分类,其中属于硅酸盐材料的是____________;
④随意丢弃_________________,会造成白色污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1---100 nm的颗粒Y(化合物),反应原理为:![]() a
a![]() 下列说法中不正确的是
下列说法中不正确的是
A.a=4 B.将Y均匀分散到水中形成的体系具有丁达尔效应
C. ![]() 是还原剂 D. 每有3 mol
是还原剂 D. 每有3 mol ![]() 参加反应,反应中转移的电子总数为5 mol
参加反应,反应中转移的电子总数为5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com