
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量低 | D. | 1mol石墨比1mol金刚石的总能量高 |
分析 在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,石墨更稳定.金刚石的能量高,1mol石墨和金刚石完全燃烧时释放的能量金刚石比石墨多.
解答 解:A、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故A错误;
B、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故B正确;
C、在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,故C正确;
D、在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,故D错误;
故选BC.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,题目难度不大,明确物质自身具有能量越低越稳定.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水即为酸雨 | |
| B. | 用食醋可除去水壶内壁上的水垢 | |
| C. | 为了除去MgCl2酸性溶液的Fe3+,可在加热搅拌的条件下加入氨水 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把一段打磨过镁带放入冷水中 | B. | 把铝条放入NaOH溶液中 | ||
| C. | 把绿豆大的钠投入到KCl溶液中 | D. | 把溴水滴加到淀粉KI溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
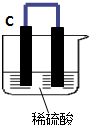 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com