
°æƒø°øA°¢B°¢C°¢D°¢EŒÂ÷÷»Ð“∫∑÷± «NaOH°¢NH3°§H2O°¢CH3COOH °¢HCl°¢NH4HSO4÷–µƒ“ª÷÷°£≥£Œ¬œ¬Ω¯––œ¬¡– µ—È£∫
¢ŸΩ´1 L pH=3µƒA»Ð“∫∑÷±”Î0.001mol°§L£≠1 xL B»Ð“∫°¢0.001mol°§L£≠1 yL D»Ð“∫≥‰∑÷∑¥”¶÷¡÷––‘£¨x°¢y¥Û–°πÿœµŒ™£∫ y£ºx£ª
¢⁄≈®∂»æ˘Œ™0.1mol°§L£≠1A∫ÕE»Ð“∫£¨pH£∫A£ºE£ª
¢€≈®∂»æ˘Œ™0.1mol°§L£≠1C”ÎD»Ð“∫µ»Ãª˝ªÏ∫œ£¨»Ð“∫≥ À·–‘°£
ªÿ¥œ¬¡–Œ £∫
(1)C «______»Ð“∫£¨D «______»Ð“∫°£
(2)100mL0.01molL©Å1µƒB»Ð“∫”Î10mL 0.1molL©Å1µƒB»Ð“∫œý±»Ωœ£¨œ¬¡– ˝÷µ÷–£¨«∞’þ¥Û”⁄∫Û’þµƒ «______ (ÃÓ–¥–Ú∫≈)
¢Ÿ![]() ¢⁄
¢⁄![]() ¢€ c£®H+£©∫Õc£®OH-£©µƒ≥Àª˝ ¢Ð OH£≠µƒŒÔ÷ µƒ¡ø
¢€ c£®H+£©∫Õc£®OH-£©µƒ≥Àª˝ ¢Ð OH£≠µƒŒÔ÷ µƒ¡ø
(3)OH£≠≈®∂»œýÕ¨µƒµ»Ãª˝µƒ¡Ω∑ð»Ð“∫A∫ÕE£¨∑÷±”Ζø∑€∑¥”¶£¨»Ù◊Ó∫ÛΩˆ”–“ª∑ð»Ð“∫÷–¥Ê‘⁄–ø∑€£¨«“∑≈≥ˆ«‚∆¯µƒ÷ ¡øœýÕ¨£¨‘Úœ¬¡–Àµ∑®’˝»∑µƒ «________(ÃÓ–¥–Ú∫≈)
¢Ÿ∑¥”¶À˘–Ë“™µƒ ±º‰E>A ¢⁄ø™ º∑¥”¶ ±µƒÀŸ¬ A>E
¢€≤Œº”∑¥”¶µƒ–ø∑€ŒÔ÷ µƒ¡øA=E ¢Ð∑¥”¶π˝≥õƒ∆Ωæ˘ÀŸ¬ E>A
¢ðA»Ð“∫¿Ô”––ø∑€ £”ý ¢ÞE»Ð“∫¿Ô”––ø∑€ £”ý
°æ¥∞∏°øNH4HSO4 NaOH ¢Ÿ¢Ð ¢€¢Ð¢ð
°æΩ‚Œˆ°ø
¢ŸΩ´1 L pH=3µƒA»Ð“∫∑÷±”Î0.001mol°§L£≠1 xL B»Ð“∫°¢0.001mol°§L£≠1 yL D»Ð“∫≥‰∑÷∑¥”¶÷¡÷––‘£¨Àµ√˜B°¢D≥ ºÓ–‘£¨x°¢y¥Û–°πÿœµŒ™£∫ y£ºx£¨Àµ√˜BµƒºÓ–‘»ı£¨À˘“‘B «NH3°§H2O°¢D «NaOH£ª¢€≈®∂»æ˘Œ™0.1mol°§L£≠1C”Ϋ‚—ıªØƒ∆»Ð“∫µ»Ãª˝ªÏ∫œ£¨»Ð“∫≥ À·–‘£¨Àµ√˜C «NH4HSO4£ª¢⁄≈®∂»æ˘Œ™0.1mol°§L£≠1A∫ÕE»Ð“∫£¨pH£∫A£ºE£¨‘ÚE «CH3COOH°¢A «HCl£ª
(1) ¢ŸΩ´1 L pH=3µƒA»Ð“∫∑÷±”Î0.001mol°§L£≠1 xL B»Ð“∫°¢0.001mol°§L£≠1 yL D»Ð“∫≥‰∑÷∑¥”¶÷¡÷––‘£¨‘ÚB°¢D≥ ºÓ–‘£¨x°¢y¥Û–°πÿœµŒ™£∫ y£ºx£¨Àµ√˜BµƒºÓ–‘»ı£¨À˘“‘B «NH3°§H2O°¢D «NaOH£ª¢€≈®∂»æ˘Œ™0.1mol°§L£≠1C”Ϋ‚—ıªØƒ∆»Ð“∫µ»Ãª˝ªÏ∫œ£¨»Ð“∫≥ À·–‘£¨Àµ√˜C «NH4HSO4£ª
(2)¢Ÿ∞±ÀÆ≈®∂»‘Ω¥Û£¨«‚—ı∏˘¿Î◊”≈®∂»‘Ω¥Û°¢«‚¿Î◊”≈®∂»‘Ω–°£¨![]() «∞’þ¥Û”⁄∫Û’þ£¨π ¢Ÿ’˝»∑£ª
«∞’þ¥Û”⁄∫Û’þ£¨π ¢Ÿ’˝»∑£ª
¢⁄∞±Àƺ”ÀÆœ° Õ£¨![]() ≤ª±‰£¨
≤ª±‰£¨![]() ºı–°£¨À˘“‘
ºı–°£¨À˘“‘![]() ºı–°£¨
ºı–°£¨![]() «∞’þ–°”⁄∫Û’þ£¨π ≤ª—°¢⁄£ª
«∞’þ–°”⁄∫Û’þ£¨π ≤ª—°¢⁄£ª
¢€ Œ¬∂»≤ª±‰£¨c£®H+£©∫Õc£®OH-£©µƒ≥Àª˝≤ª±‰£¨«∞’þµ»”⁄∫Û’þ£¨π ≤ª—°¢€£ª
¢Ð100mL0.01molL©Å1µƒ∞±ÀÆ∫Õ10mL 0.1molL©Å1µƒ∞±ÀÆ»Ð÷ ŒÔ÷ µƒ¡øœýµ»£¨»Ð“∫‘Ωœ°£¨∞±ÀƵÁ¿Î≥Ã∂»‘Ω¥Û£¨µÁ¿Î≥ˆµƒOH£≠µƒŒÔ÷ µƒ¡ø‘Ω¥Û£¨«∞’þ¥Û”⁄∫Û’þ£¨π —°¢Ð£ª
(3)¢Ÿø™ º ±£¨OH£≠≈®∂»œýÕ¨£¨º¥«‚¿Î◊”≈®∂»œýÕ¨£¨”…”⁄¥◊À· «»ıÀ·£¨ø™ º∫Û¥◊À·¥◊À·ºÃ–¯µÁ¿Î£¨À˘“‘¥◊À·∑¥”¶øÏ£¨—ŒÀ·∫Õ¥◊À·∑¥”¶À˘–Ë“™µƒ ±º‰—ŒÀ·>¥◊À·£¨π ¢Ÿ¥ÌŒÛ£ª
¢⁄ø™ º∑¥”¶ ±£¨OH£≠≈®∂»œýÕ¨£¨º¥«‚¿Î◊”≈®∂»œýÕ¨£¨À˘“‘ø™ º∑¥”¶µƒÀŸ¬ œýµ»£¨π ¢⁄¥ÌŒÛ£ª
¢€∑¥”¶…˙≥…«‚∆¯µƒ¡øœýµ»£¨À˘“‘≤Œº”∑¥”¶µƒ–ø∑€ŒÔ÷ µƒ¡øœýµ»£¨π ¢€’˝»∑£ª
¢Ðø™ º ±£¨OH£≠≈®∂»œýÕ¨£¨º¥«‚¿Î◊”≈®∂»œýÕ¨£¨”…”⁄¥◊À· «»ıÀ·£¨ø™ º∫Û¥◊À·∑¥”¶øÏ£¨∑¥”¶π˝≥õƒ∆Ωæ˘ÀŸ¬ £∫¥◊À·>—ŒÀ·£¨π ¢Ð’˝»∑£ª
¢ð¥◊À·µƒŒÔ÷ µƒ¡ø¥Û”⁄—ŒÀ·£¨∑≈≥ˆ«‚∆¯“ª—˘∂ý£¨Àµ√˜¥◊À·”– £”ý£¨¥◊À·÷–µƒ–ø∑€ÕÍ»´∑¥”¶£¨‘Ú—ŒÀ·»Ð“∫¿Ô”––ø∑€ £”ý£¨π ¢ð’˝»∑£ª
¢Þ¥◊À·”– £”ý£¨¥◊À·÷–µƒ–ø∑€ÕÍ»´∑¥”¶£¨‘Ú—ŒÀ·»Ð“∫¿Ô”––ø∑€ £”ý£¨π ¢Þ¥ÌŒÛ£ª—°¢€¢Ð¢ð°£


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥—–æø–‘—ßœ∞–°◊Ȝړª∂®¡øµƒNaHSO3»Ð“∫(º”»Î…Ÿ¡øµÌ∑€)÷–º”»Î…‘π˝¡øµƒKIO3»Ð“∫£¨“ª∂Œ ±º‰∫Û£¨»Ð“∫Õª»ª±‰¿∂…´°£Õ®π˝≤‚∂®»Ð“∫±‰¿∂À˘”√ ±º‰¿¥ÃΩæøÕ‚ΩÁÃıº˛∂‘∏√∑¥”¶ÀŸ¬ µƒ”∞œÏ£¨º«¬º»Áœ¬°£
±ý∫≈ | 0.01mol/LNaHSO3»Ð“∫/mL | 0.01mol/L KIO3»Ð“∫/mL | H2O/mL | ∑¥”¶Œ¬∂»/°„C | »Ð“∫±‰¿∂À˘”√ ±º‰t/s |
¢Ÿ | 6.0 | 10.0 | 4.0 | 15 | t1 |
¢⁄ | 6.0 | 14.0 | 0 | 15 | t2 |
¢€ | 6.0 | a | b | 25 | t3 |
(1) µ—È¢Ÿ¢⁄ «ÃΩæø_______________∂‘∑¥”¶ÀŸ¬ µƒ”∞œÏ£¨±Ì÷–t1_________t2(ÃÓ°∞>°±°¢°∞=°±ªÚ°∞<°±)£ª µ—È¢Ÿ¢€ «ÃΩæøŒ¬∂»∂‘∑¥”¶ÀŸ¬ µƒ”∞œÏ£¨±Ì÷–a=_________£¨b=_________°£
(2)∏ƒ±‰∑¥”¶Œ¬∂»£¨÷ÿ∏¥ µ—È¢€£¨µ√µΩ»Ð“∫±‰¿∂À˘–Ë ±º‰(t)”ÎŒ¬∂»(T)µƒπÿœµ»ÁÕºÀ˘ æ(≥¨π˝50°„C∫ۻГ∫≤ªª·‘Ÿ±‰¿∂)°£a°¢b°¢c°¢dÀƒµ„÷–£¨∑¥”¶ÀŸ¬ ◊Óøϵƒ «_________°£(ÃÓ—°œÓ)

A£Æaµ„ B£Æbµ„ C£Æcµ„ D£Ædµ„
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¥”∫£ÀÆ÷–ø…“‘ªÒµ√µ≠ÀÆ°¢ ≥—Œ£¨≤¢ø…÷»°√æ∫Չµ»ŒÔ÷ °£
£®1£©¥”∫£ÀÆ÷–÷»°√浃¡˜≥ûÁÕºÀ˘ æ£∫
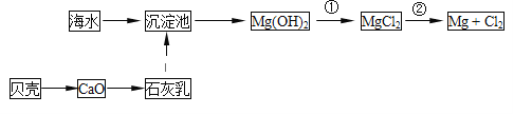
∑¥”¶¢Ÿµƒ¿Î◊”∑Ω≥Ã ΩŒ™__£ª
∑¥”¶¢⁄µƒªØ—ß∑Ω≥Ã ΩŒ™__£ª
£®2£©∫£ÀÆ÷»°‰Â¡˜≥ã∫
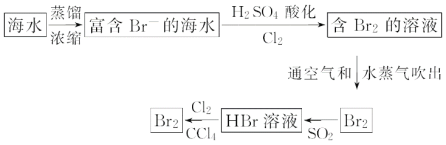
¢Ÿ∏√¡˜≥Ã÷–…ʺ∞∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω£∫ __£ª ___£ª
¢⁄∏√¡˜≥Ã÷–‰Â‘™Àÿ±ª—ıªØ”÷±ªªπ‘≠”÷±ª—ıªØµƒƒøµƒ «£∫___£ª
¢€¥”◊Ó÷’‰ÂµƒÀƒ¬»ªØú»Ð“∫÷–µ√µΩ“∫‰Â£¨”¶≤…»°µƒ≤Ÿ◊˜ «__°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø”˚≤‚∂®ƒ≥HCl»Ð“∫µƒŒÔ÷ µƒ¡ø≈®∂»£¨ø…”√0.1000mol°§L-1NaOH±Í◊º»Ð“∫Ω¯––÷–∫ÕµŒ∂®£®”√∑”Ù◊˜÷∏ 溡£©°£
«Îªÿ¥œ¬¡–Œ £∫

(1)»Ùº◊—ß…˙‘⁄ µ—Èπ˝≥Ã÷–£¨º«¬ºµŒ∂®«∞µŒ∂®πЃ⁄“∫√Ê∂¡ ˝Œ™1.10mL£¨µŒ∂®∫Û“∫√Ê»ÁÕº£¨‘Ú¥À ±œ˚∫ƒ±Í◊º»Ð“∫µƒÃª˝Œ™ ___________£ª
(2)““—ß…˙◊ˆ¡À»˝◊È∆Ω–– µ—È£¨ ˝æ𺫬º»Áœ¬£∫
µ—È –Ú∫≈ | ¥˝≤‚HCl»Ð“∫µƒÃª˝/mL | 0.1000mol°§L-1NaOH»Ð“∫µƒÃª˝/mL | |
µŒ∂®«∞øÃ∂» | µŒ∂®∫ÛøÃ∂» | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
—°»°…œ ˆ∫œ¿Ì ˝æ𣨺∆À„≥ˆHCl¥˝≤‚»Ð“∫µƒŒÔ÷ µƒ¡ø≈®∂»Œ™ ________mol°§L-1£®–° ˝µ„∫Û±£¡ÙÀƒŒª£©£ª
(3)µŒ∂® ±µƒ’˝»∑≤Ÿ◊˜ «_____________________________________________________°£µŒ∂®¥ÔµΩ÷’µ„µƒœ÷œÛ «_____________________________________________£ª¥À ±◊∂–Œ∆øƒ⁄»Ð“∫µƒpHµƒ∑∂Œß «________°£
(4)œ¬¡–ƒƒ–©≤Ÿ◊˜ª· π≤‚∂®Ω·π˚∆´∏þ_______________£®ÃÓ–Ú∫≈£©°£
A£Æ◊∂–Œ∆ø”√’Ù¡ÛÀÆœ¥æª∫Û‘Ÿ”√¥˝≤‚“∫»Ûœ¥
B£ÆÀ· ΩµŒ∂®πД√’Ù¡ÛÀÆœ¥æª∫Û‘Ÿ”√±Í◊º“∫»Ûœ¥
C£ÆµŒ∂®«∞ºÓ ΩµŒ∂®πк‚∂À∆¯≈ðŒ¥≈≈≥˝£¨µŒ∂®∫Û∆¯≈ðœ˚ ß
D£ÆµŒ∂®«∞∂¡ ˝’˝»∑£¨µŒ∂®∫Û∏© ”µŒ∂®πÐ∂¡ ˝
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø÷Ð∆⁄±Ì«∞Àƒ÷Ð∆⁄µƒ‘™Àÿa°¢b°¢c°¢d°¢e£¨‘≠◊”–Ú ˝“¿¥Œ‘ˆ¥Û°£aµƒ∫ÀÕ‚µÁ◊”◊Ð ˝”Î∆‰÷Ð∆⁄ ˝œýÕ¨£ªª˘Ã¨b‘≠◊”µƒ∫ÀÕ‚µÁ◊”’ºæð3∏ˆƒÐº∂£¨«“◊Ó∏þƒÐº∂πϵ¿Œ™∞Î≥‰¬˙◊¥Ã¨£ªcµƒ◊ÓÕ‚≤„µÁ◊” ˝ «ƒ⁄≤„µÁ◊” ˝µƒ3±∂£ªdµƒ‘≠◊”–Ú ˝ «cµƒ¡Ω±∂£ªª˘Ã¨e‘≠◊”3dπϵ¿…œ”–4∏ˆµ•µÁ◊”°£
ªÿ¥œ¬¡–Œ £∫
£®1£©b°¢c°¢dµÁ∏∫–‘◊Ó¥Ûµƒ «___(ÃÓ‘™Àÿ∑˚∫≈)°£
£®2£©bµ•÷ ∑÷◊”÷–¶“º¸”ζ–º¸µƒ∏ˆ ˝±»Œ™___°£
£®3£©a”Îcø…–Œ≥…¡Ω÷÷∂˛‘™ªØ∫œŒÔ∑÷◊”£¨¡Ω÷÷ŒÔ÷ ø…“‘»Œ“‚±»ª•»Ð°£∆‰÷–“ª÷÷≤ªŒ»∂®£¨ø…∑÷Ω‚≤˙…˙cµƒµ•÷ £¨∏√ªØ∫œŒÔ∑÷◊”÷–µƒc‘≠◊”µƒ‘”ªØ∑Ω ΩŒ™___£ª’‚¡Ω÷÷ŒÔ÷ µƒª•»ÐŒÔ÷–£¨¥Ê‘⁄µƒªØ—ߺ¸”–___(ÃÓ–Ú∫≈)°£
¢Ÿº´–‘π≤º€º¸ ¢⁄∑«º´–‘π≤º€º¸ ¢€¿Î◊”º¸ ¢ÐΩ Ùº¸ ¢ð«‚º¸ ¢Þ∑∂µ¬ª™¡¶
£®4£©’‚–©‘™Àÿ–Œ≥…µƒ∫¨—ıÀ·÷–£¨∑÷◊”ƒ⁄÷––ƒ‘≠◊”µƒº€≤„µÁ◊”∂‘ ˝Œ™4µƒÀ· «___(ÃÓªØ—ß Ω£¨œ¬Õ¨)£ªÀ·∏˘≥ ’˝»˝Ω«–ŒΩ·ππµƒÀ· «___£¨ ‘¥”¡Ω’þΩ·ππÃÿµ„≈–∂œ∏√À·∑÷◊””ÎÀ·∏˘¿Î◊”µƒŒ»∂®–‘£∫À·∑÷◊”___À·∏˘¿Î◊”(ÃÓ°∞>°±ªÚ°∞<°±)°£
£®5£©‘™Àÿe‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√ «___«¯£ªeµƒ“ª÷÷≥£º˚¬»ªØŒÔ÷–µƒªØ—ߺ¸æþ”–√˜œ‘µƒπ≤º€–‘£¨’Ù∆˚◊¥Ã¨œ¬“‘À´æ€∑÷◊”¥Ê‘⁄£¨Ω·ππ ΩŒ™![]() £¨«Î≤π–¥eµƒ‘™Àÿ∑˚∫≈≤¢”√°∞°˙°±±Ì æ≥ˆ∆‰÷–µƒ≈‰Œªº¸___°£
£¨«Î≤π–¥eµƒ‘™Àÿ∑˚∫≈≤¢”√°∞°˙°±±Ì æ≥ˆ∆‰÷–µƒ≈‰Œªº¸___°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øT°Ê ±£¨‘⁄“ª∏ˆÃª˝Œ™2Lµƒ»ð∆˜÷–£¨A∆¯Ã”ÎB∆¯ÃÂ∑¥”¶…˙≥…C∆¯Ã£¨∑¥”¶π˝≥Ã÷–A°¢B°¢C≈®∂»±‰ªØ»ÁÕºÀ˘ æ£Æ
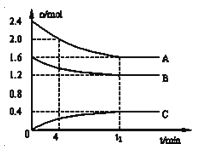
1£©–¥≥ˆ∏√∑¥”¶µƒ∑Ω≥Ã Ω£∫__________________
2£©º∆À„∏√Œ¬∂»œ¬∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝£∫____________
3£©“—÷™£∫K£®300°Ê£©<K£®350°Ê£©£¨∏√∑¥”¶ «__________»»∑¥”¶£Æ
4£©0°´4∑÷÷” ±£¨Bµƒ∆Ωæ˘∑¥”¶ÀŸ¬ Œ™£∫____________
5£©µΩ¥Ô∆Ω∫‚ ±Aµƒ◊™ªØ¬ Œ™£∫____________
6£©∫„»ðÃıº˛œ¬£¨œ¬¡–¥Î ©÷–ƒÐ πn(A)/n(C)ΩµµÕµƒ”–____________£Æ
A£Æ≥‰»Î∫§∆¯ B£Æ π”√¥þªØº¡
C£Æ‘Ÿ≥‰»Î2.4molA∫Õ1.6molB D£ÆΩµµÕŒ¬∂»£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥Œ¬∂»œ¬HFµƒµÁ¿Î≥£ ˝Ka=3.3°¡10-4 mol°§L-1£¨CaF2µƒ»Ð∂»ª˝≥£ ˝Ksp=1.46°¡10-10£®mol°§L-1£©3°£‘⁄∏√Œ¬∂»œ¬»°≈®∂»Œ™0.31 mol°§L-1µƒHF”Î≈®∂»Œ™0.002 mol°§L-1µƒCaCl2»Ð“∫µ»Ãª˝ªÏ∫œ°£œ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A.∏√Œ¬∂»œ¬£¨0.31 mol°§L-1µƒHF»Ð“∫µƒpH=2
B.…˝∏þŒ¬∂»ªÚ‘ˆ¥Û≈®∂»£¨HFµƒµÁ¿Î∆Ω∫‚≥£ ˝∂ºΩ´‘ˆ¥Û
C.¡Ω»Ð“∫ªÏ∫œ≤ªª·≤˙…˙≥¡µÌ
D.œÚ±•∫ÕµƒCaF2»Ð“∫÷–º”ÀÆ∫Û£¨c(Ca2+)“ª∂®±»º”ÀÆ«∞ºı–°
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥Œ¬∂»œ¬£¨œÚ10mL0.1mol/LCuCl2»Ð“∫÷–µŒº”0.1mol/LµƒNa2S»Ð“∫£¨µŒº”π˝≥Ã÷–»Ð“∫÷–©Ålgc(Cu2+)”ÎNa2S»Ð“∫ê˝(V)µƒπÿœµ»ÁÕºÀ˘ 棨œ¬¡–”–πÿÀµ∑®’˝»∑µƒ «
(“—÷™£∫Ksp(ZnS)=3°¡10©Å25mol2/L2)

A. a°¢b°¢c»˝µ„÷–£¨ÀƵƒµÁ¿Î≥Ã∂»◊Ó¥ÛµƒŒ™bµ„
B. Na2S»Ð“∫÷–£∫c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. ∏√Œ¬∂»œ¬Ksp(CuS)=10©Å35.4mol2/L2
D. œÚ100 mLZn2+°¢Cu2+≈®∂»æ˘Œ™10-5mol/LµƒªÏ∫œ»Ð“∫÷–÷µŒº”»Î10-4mol/LµƒNa2S»Ð“∫£¨Zn2+œ»≥¡µÌ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“ª∂®Œ¬∂»œ¬£¨‘⁄»˝∏ˆÃª˝æ˘Œ™ 2.0L µƒ∫„»ð√б’»ð∆˜÷–∑¢…˙»Áœ¬∑¥”¶£∫A(g)![]() B(g)£´C(g)
B(g)£´C(g) ![]() H£æ0°£
H£æ0°£
∆ ºŒÔ÷ µƒ¡ø(mol) | ∆Ω∫‚ŒÔ÷ µƒ¡ø(mol) | |||||
»ð∆˜ | Œ¬∂»(°Ê) | A(g) | B(g) | C(g) | ¥ÔµΩ∆Ω∫‚À˘–Ë ±º‰(s) | |
¢Ò | T1 | 0.20 | 0.10 | 0.10 | t1 | |
¢Ú | T2 | 0.40 | t2 | |||
¢Û | T3 | 0.20 | 0.15 | 0.15 | t3 | |
œ¬¡–Àµ∑®’˝»∑µƒ «( )
A.¥ÔµΩ∆Ω∫‚µƒ ±º‰£∫t3£æt1
B.∑¥”¶¥ÔµΩ∆Ω∫‚ ±£¨A µƒ◊™ªØ¬ £∫»ð∆˜¢Ú£æ»ð∆˜
C.∑¥”¶¥ÔµΩ∆Ω∫‚ ±£¨»ð∆˜ I ÷–µƒ∆Ωæ˘ÀŸ¬ Œ™ v(A)£Ω(0.10/t1)mol/(L°§s)
D.T1 ±£¨∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝Œ™ 0.05
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com