
【题目】氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
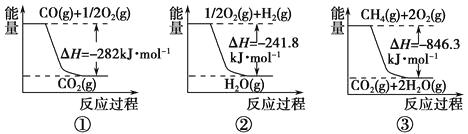
反应①②③均为____________反应(填“吸热”或“放热”)。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。为进一步提高CO2
CO(NH2)2(l)+H2O(g)。为进一步提高CO2
的平衡转化率,下列措施中能达到目的的是____________。
A.增大NH3的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
(3)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g)![]() NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
(NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
①第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于___________.(填“第一步”或“第二步”)
②对于第一步反应,不能判断该反应一定达到化学平衡状态的依据是__________(填字母).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ(NH3)正=2υ(CO2)逆
C.恒容容器中气体的密度不随时间变化而变化
D.容器中各物质总质量不随时间变化而变化
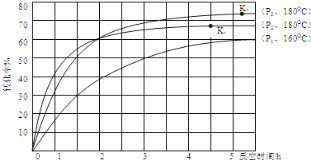
③第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如图所示:
在180℃的条件下,P2_________P3(填“>”、“<”或“=”,下同);化学平衡常数K1_________K2.
【答案】(1)放热;(2)AB;(3)①第二步;②AD;③>;=。
【解析】
试题分析:(1)①②③的反应物的总能量大于生成物的总能量,说明反应是放热反应,或者通过△H<0进行判断;(2)提高CO2的转化率,说明平衡向正反应方向进行,A、增大NH3的浓度,增大反应物的浓度,平衡向正反应方向进行,CO2总量不变,转化量增大,CO2的转化率增大,故正确;B、增大压强,平衡向正反应方向移动,CO2的转化率增大,故正确;C、尿素是液态物质,浓度视为常数,对化学平衡无影响,故错误;D、 使用催化剂,对化学平衡无影响,故错误;(3)①总反应速率好转化率的主要取决于反应慢的,即第二步;②A、NH2COONH4是液体,NH3和CO2的平均分子量始终不变,因此不能判断是否达到平衡,故正确;B、用不同种物质的化学反应速率,判断达到平衡,要求化学反应方向一正一逆,且化学反应速率之比等于化学计量数之比,v(NH3)正,说明反应向正反应方向进行,v(CO2)逆说明反应向逆反应方向进行,且两者速率之比等于化学计量数之比,能够判断达到平衡,故错误;C、NH2COONH4是液体,这是在恒压下测定,NH3和CO2的质量减小与它们的物质的量增加的量比例相等,因此密度不变,不能作为达到平衡的标志,故正确;D、当各物质的质量不再改变,说明反应达到平衡,故错误;③压强越大,化学反应速率越快,达到平衡的时间越短,即P2>P3,化学平衡常数只受温度的影响,不随压强的变化而变化,因此K1=K2。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
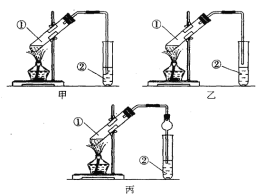
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填 “甲”或 “乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是 。
【问题讨论】
a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、 、 ;
b.试管②中饱和 Na2CO3 溶液的作用是 (填编号)。
A.溶解乙醇 B.降低乙酸乙酯的溶解度 C.中和乙酸
c.从试管②中分离出乙酸乙酯的实验操作是 。
d.生成乙酸乙酯的化学反应方程式 。
f.乙醇在铜或银作催化剂时,可以被氧化为一种有刺激性气味的物质,写出该反应的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
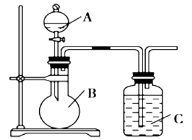
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,强酸一般能制取弱酸。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择所给试剂,用如上图装置来证明酸性:HNO3>H2CO3>H2SiO3。(不考虑硝酸的挥发性)
A、B、C中盛装的试剂分别为____________、____________、____________。C中实验现象为____________________;
写出C中发生反应的离子方程式:____________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用上图装置证明氯气氧化性强于碘单质的氧化性。A中盛装浓盐酸,B中装入高锰酸钾粉末,实验时C中溶液变成蓝色,则:C中盛装的试剂为_________________;写出C中离子方程式_____________________。该实验该装置有明显不足,请指出改进方法:__________________________。
(3)如果C中盛装饱和氢硫酸(H2S饱和水溶液),A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀。写出该反应的化学方程式:_____________;如果将SO2气体通入到饱和氢硫酸溶液中,也会产生淡黄色沉淀,该过程体现SO2 (填序号)。
A.漂白性 B.氧化性 C.还原性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是( )
A. NaOH B. MgO C. 氨水 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是 ( )
A. 生石灰——Ca(OH)2 B. 铁红——Fe2O3
C. 水玻璃——H2SiO3 D. 酒精——CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )
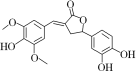
A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与4 mol NaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸可用作化学原料和中间体,其结构如图。下列关于咖啡酸说法不正确的是( )

A.能发生加聚反应
B.能使酸性高锰酸钾溶液褪色
C.1 mol咖啡酸最多能与3 mol NaOH反应
D.1 mol咖啡酸最多能与3 mol Br2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛是一种食用香精,广泛应用于牙膏、糖果及调味品中。工业上可通过下列反应制得:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.肉桂醛的分子式为C9H8O
B.检验肉桂醛中是否有残留的苯甲醛:加入酸性KMnO4溶液,看是否褪色
C.1 mol肉桂醛完全燃烧消耗10.5 mol O2
D.肉桂醛分子中含有的官能团:醛基、碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为主要原料,制取高分子材料N和R的流程如下:
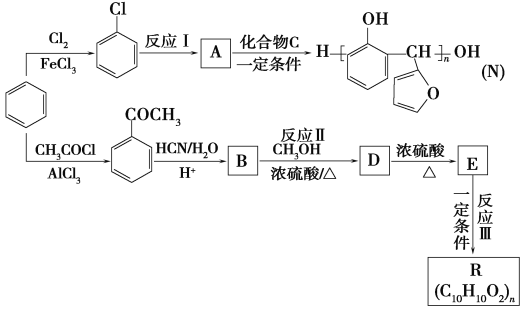
已知: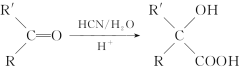
(1)B中含氧官能团的名称是________。
(2)由![]() 生成
生成![]() 的反应类型是________。
的反应类型是________。
(3)反应Ⅰ的反应条件是________。
(4)化合物C的结构简式是________。
(5)反应Ⅱ的化学反应方程式是________。
(6)下列说法正确的是________(填字母)。
a.A可与NaOH溶液反应
b.常温下,A能和水以任意比混溶
c.化合物C可使酸性高锰酸钾溶液褪色
d.E存在顺反异构体
(7)反应Ⅲ的化学反应方程式是________。
(8)符合下列条件的B的同分异构体有________种。
a.能与饱和溴水反应生成白色沉淀
b.属于酯类
c.苯环上只有两个对位取代基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com