
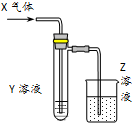
 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.甲醛和新制氢氧化铜的反应,新制氢氧化铜为碱性溶液,反应需要加热才能观察到红色沉淀;
B.CH3Cl中是氯原子,不能和硝酸银溶液发生反应;
C.二氧化硫和高锰酸钾溶液的反应是利用二氧化硫的还原性,二氧化硫被高锰酸钾溶液氧化为硫酸溶液褪色,剩余二氧化硫被氢氧化钠溶液吸收;
D.氯气通过淀粉碘化钾溶液发生氧化还原反应,氯气氧化碘离子为碘单质,碘单质遇到淀粉变蓝色,剩余氯气被氢氧化钠溶液吸收.
解答 解:A.新制氢氧化铜为碱性溶液,反应需要加热才能观察到红色沉淀,装置图无加热装置,反应不能进行,不能验证甲醛的还原性,故A错误;
B.应是一氯甲烷先水解得到氯离子后,加酸再加入硝酸银溶液检验氯元素的存在,CH3Cl中是氯原子,不能和硝酸银溶液发生反应,不能验证一氯甲烷含氯元素,故B错误;
C.二氧化硫和高锰酸钾溶液的反应是利用二氧化硫的还原性,二氧化硫还原高锰酸钾溶液褪色,剩余二氧化硫被氢氧化钠溶液吸收防止污染环境,不能验证二氧化硫的漂白性,故C错误;
D.氯气通过淀粉碘化钾溶液发生氧化还原反应,氯气氧化碘离子为碘单质,Cl2+2I-=I2+2Cl-,碘单质遇到淀粉变蓝色,证明了氯气具有氧化性,剩余氯气被氢氧化钠溶液吸收防止污染空气,能验证氯气的强氧化性,故D正确;
故选D.
点评 本题考查了气体的性质和实验检验方法,注意实验条件的掌握,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲和乙中反应的化学平衡常数相同 | |
| B. | 乙和丙中的二氧化硫的生成速率相同 | |
| C. | 乙中SO3的体积分数大于丙 | |
| D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
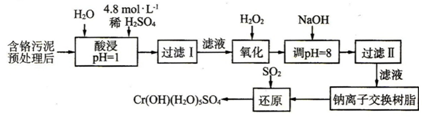
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com