
| A. | 在NaHS溶液中滴人少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大,pH增大 | |
| B. | 常温下,由于HCO3-水解显碱性,所以饱和NaHCO3溶液显碱性 | |
| C. | 泡沫灭火器是利用Al2(SO4)3溶液与饱和NaHCO3溶液混合产生气体 | |
| D. | 配制氯化铝溶液时,先将氯化铝溶于浓硫酸,再加水稀释 |
分析 A.在NaHS溶液中存在HS-?H++S2-,加入CuCl2溶液铜离子与硫离子结合生成硫化铜,导致硫离子浓度减少,促进电离;
B.碳酸氢根离子为弱酸的酸式根离子,既存在水解又存在电离,水解程度大于电离程度;
C.铝离子与碳酸氢根离子能够发生双水解生成氢氧化铝和二氧化碳;
D.抑制水解应避免引入新杂质.
解答 解:A.在NaHS溶液中存在HS-?H++S2-,加入CuCl2溶液铜离子与硫离子结合生成硫化铜,导致硫离子浓度减少,促进电离,氢离子的浓度增大,溶液的PH减小,故A误;
B.碳酸氢根离子为弱酸的酸式根离子,既存在水解又存在电离,水解程度大于电离程度,所以饱和碳酸氢钠溶液显碱性,故B错误;
C.泡沫灭火器原理为:用NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,故C正确;
D.配制氯化铝溶液时,先将氯化铝溶于浓盐酸,再加水稀释,不能用浓硫酸溶解,否则引入杂质,故D错误;
故选:C.
点评 本题考查了元素化合物知识,解题的关键是明确盐类水解的原理及应用,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 同一周期元素的最高化合价从左到右从+1递增到+7 | |
| C. | IA族与ⅦA族元素间形成的化合物,有共价化合物也有离子化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2═2H2O+O2↑ | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | Pb2++2Cl-═PbCl2↓ | D. | Sn2++2Fe3+═Sn4++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
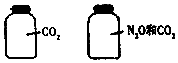 如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )| A. | 所含氧原子数相等 | B. | 气体的总质量相等 | ||
| C. | 气体的平均摩尔质量相等 | D. | 气体的密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
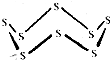 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 还原产物为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,纯水中含有的H+数为1×10-7NA | |
| B. | 常温常压下,31g白磷与红磷的混合物中含有磷原子数为NA | |
| C. | 35.5gCl2参加氧化还原反应,转移的电子数可能为NA | |
| D. | 7.8gNa2O2晶体中所含离子的总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应涉及两种基本反应类型 | B. | 丹砂的主要成分是硫化汞 | ||
| C. | “积变”属于复分解反应 | D. | 丹砂“烧之”涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | KSCN溶液 | C. | 氨水 | D. | 烧碱溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com