
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO 、SO
、SO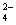 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A.甲溶液含有Ba2+ B.乙溶液含有SO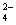
C.丙溶液含有Cl- D.丁溶液哈有Mg2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO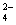 和CO
和CO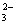
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子 B.Cl– 一定存在,且c(Cl–)≥0.4mol/L
C.SO42–、NH4+一定存在,Cl–可能不存在 D.CO32–、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对离子方程式的评价不合理的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2===Cl-+SO | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为
A.NH4HCO3溶于过量的浓KOH溶液中:
NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是  ( )
( )
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失去电子多的还原剂还原性强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com