
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势,有望取代锂离子电池。最近,山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaxFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
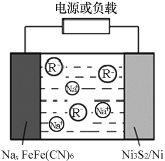
A.充电时,Na+被还原为金属钠
B.充电时,阴极反应式:xNa++FeIIFeIII(CN)6xe![]() NaxFeIIFeIII(CN)6
NaxFeIIFeIII(CN)6
C.放电时,NaxFeIIFeIII(CN)6为正极
D.放电时,Na+移向Ni3S2/Ni电极
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
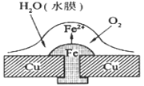
A. 此过程中铜并不被腐蚀
B. 此过程中正极电极反应式为:2H++2e- = H2↑
C. 此过程中电子从Fe移向Cu
D. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.68LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗溶液NaOH的体积是( )
A.60mLB.45mLC.30mLD.15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 相同质量的CO与N2,所含分子数、原子数均相同
B. 31g白磷中所含共价键数目为NA
C. 56g乙烯中所含共用电子对数目为12NA
D. 14g乙烯与丙烯的混合气体中所含氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体徤康,化合物H是一种临床治疗高血脂症的药物。H的结构简式如图所示。
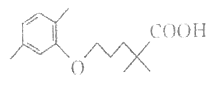
下列说法不正确的是( )
A. 有机物H含有的官能团只有羧基
B. 1mol H完全燃烧消耗19molO2
C. 有机物H是芳香化合物
D. 有机物H能和钠、碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是前四周期元素,原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y的原子半径是在同周期中最大;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子己全充满,最外层只有2个电子。
请回答下列问题:
(1)Y元素在周期表中的位置是_________; W2+离子的价电子排布式为__________。
(2)X能与S、氮、氧二种元素构成化合物XO(NH2)2,其中X原子和N原子的杂化方式为分别为_____、____,该化合物分子中的π键与![]() 键的个数之比是____;该物质易溶于水的主要原因是____。
键的个数之比是____;该物质易溶于水的主要原因是____。
(3)己知Be和A1元素处于周期表中对角线位置,化学性质相似,请写出Y元素的最高价氧化物对应水化物与Be相互反应的化学方程式:____________。
(4)M晶体的原子堆积如图所示,则该晶体的堆积方式为________,晶体中M原子的配位数是_____。某M配合物的化学式是[M(H2O)5C1]Cl2·H2O,1mol该配合物中含配位键是_____mol。

(5)Y离子和Z离子比较,半径较大的是__________(填离子符号)元素Y与元素Z形成了晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最接近的Y离子有__________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
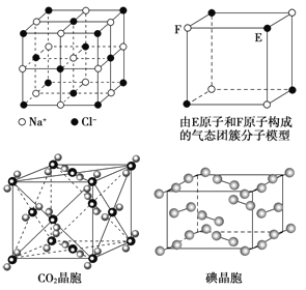
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 每个该气态团簇分子的分子中含有1/2个E原子
C. 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D. 在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管5~10min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知乙醇可以与氯化钙反应,生成微溶于水的CaCl26C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
(1)上述实验中饱和Na2CO3溶液的作用是_________。
(2)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是_________。
(3)写出步骤③中观察到的实验现象_________。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤,通过洗涤可除去的杂质是_________(填名称)。
(5)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为_________。(保留一位小数)
(6)某化学课外小组设计了图乙所示的装置制取乙酸乙酯(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有_________(填字母)。
a.增加了温度计,有利于控制反应温度b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,利于收集产物d.反应容器容积大,容纳反应物的量多,反应速率快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com