
| A. | CH4、C2H6O、CH3Cl | B. | C100H202、C6H6、C2H2 | ||
| C. | H2O2、CH4、C2H6 | D. | C2H4、CH4、C6H5NO2 |
科目:高中化学 来源: 题型:选择题
| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
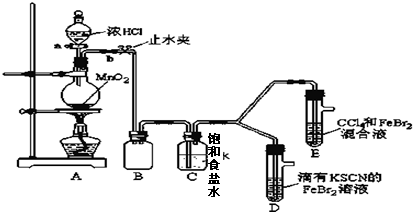
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 | |
| C. | 氢气在氯气中安静燃烧,生成白烟 | |
| D. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
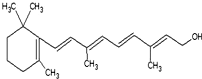 (1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.
(1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
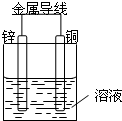 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com