
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
提出假设:小组同学经过分析讨论认为生成气体可能含H2和SO2.
(1)认为生成气体中含H2的理由是________.
设计实验方案,验证假设:主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
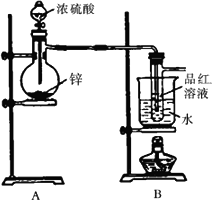
Ⅱ.检验产物中含有H2,实验内容为将由B部分导出的气体依次通过装置C、D、E、F.
(2)盛放锌粒的仪器名称是________.
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性.实验中操作及现象是________.
(4)Ⅱ中装置C、D、E、F、G的信息如下表所示:

①装置C、D的作用依次是________、________.
②E中发生反应的化学方程式是________.
③试剂X是________.
(5)有人提出方案Ⅱ在确认产物中存在H2并不严密,请你提出改进建议:________
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| 步骤一 | 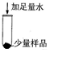 |
固体部分溶解 固体部分溶解 |
猜想二成立 |
| 步骤二 | 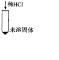 |
固体溶解,产生气泡 固体溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010届郑州高中毕业班第三次质量预测理综化学部分 题型:实验题
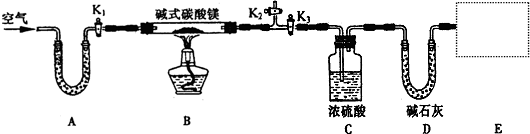
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省宝鸡市高三质检(一)理综化学试卷(解析版) 题型:填空题
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
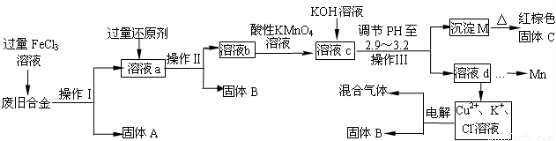
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是?????? 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:????????????????? 。
(3)过量的还原剂应是??????? ,溶液b中所含的金属阳离子有???????? 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为??????????????????? 。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为??????? g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:??? >??? >?? 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为????? L(用含Z的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com