


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
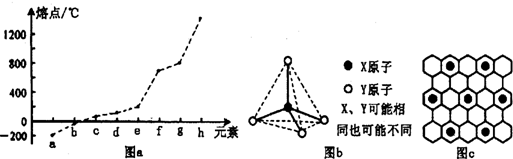
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
查看答案和解析>>
科目:高中化学 来源:高一化学 第1章 原子结构与元素周期律 1.3.2预测同主族元素的性质(鲁科版必修2) 题型:022
下表为元素周期表的一部分,用化学式或元素符号回答下列问题:
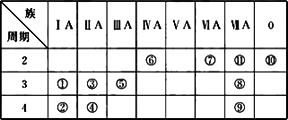
(1)11种元素中化学性质最不活泼的是________.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是(填化学式)________.
(3)①③⑤⑦⑧中形成的简单离子,半径由大到小的顺序是________.
(4)元素⑦的氢化物常温下和元素②的单质反应的离子方程式是________.该氢化物与元素⑧的单质反应的离子方程式是________.
(5)④和⑨两元素形成化合物的溶液和元素⑧的单质反应的离子方程式为________.
(6)⑤的氧化物和①的最高价氧化物对应的水化物相互反应的离子方程式为________.
(7)⑦⑧三种元素形成的气态氢化物最稳定的是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 10个电子 | 18个电子 |
单核 |
|
|
双核 |
|
|
三核 |
|
|
四核 |
|
|
五核 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
用化学符号(元素符号或化学式或离子符号)表示由一定数目的原子核(单核、双核……)和核外电子(10电子,18电子)构成的微粒,填写下表:
| 10个电子 | 18个电子 | |
| 单核 | ||
| 双核 | ||
| 三核 | ||
| 四核 | ||
| 五核 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
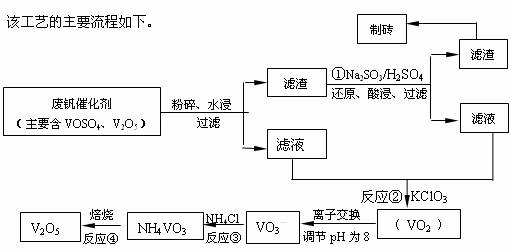
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示。则NH4VO3在分解过程中 。
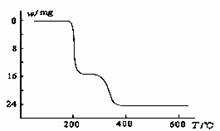
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com