
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.分析 (1)电解CuCl2溶液的装置,其中c、d为石墨电极,依据电流流向可知,电源电极a为正极,与a连接的电极c为电解池的阳极;b为负极,与b电极相连的电极d为电解池的阴极;
(2)阳极是c电极,溶液中氯离子失电子生成氯气,依据氯气使湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
(3)依据电极反应计算反应过程中的电子转移数.
解答 解:(1)电解CuCl2溶液的装置,其中c、d为石墨电极,依据电流流向可知,电源电极a为正极,与a连接的电极c为电解池的阳极;b为负极,与b电极相连的电极d为电解池的阴极,
故答案为:a;c;
(2)阳极是c电极,溶液中氯离子在阳极失电子发生氧化反应,电极反应为:2Cl-一2e一=C12↑;生成的氯气用湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
故答案为:2Cl-一2e一=C12↑;用湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
(3)电解一段时间后发现阴极增重6.4g,依据离子放电顺序溶液中铜离子得到电子生成铜,物质的量=6.4÷64=0.1mol,电极反应为:Cu2++2e-=Cu,电子转移0.2mol,外电路中通过的电子的物质的量是0.2mol,
故答案为:0.2.
点评 本题考查了电解池原理的分析判断,依据电流流向分析判断电极名称,书写电极反应是关键,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:多选题
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
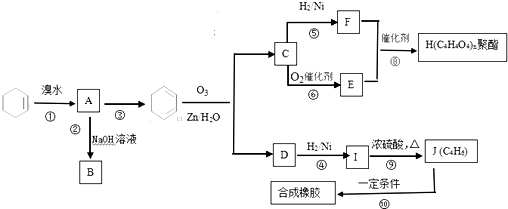
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
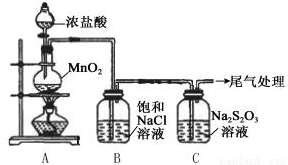
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
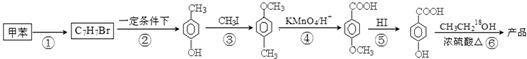
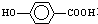 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.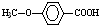 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
.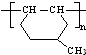 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
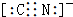 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙酮与HCN发生加成反应 | |
| B. | 1,3-丁二烯生成 聚1,3-丁二烯 | |
| C. | 乙二醇与重铬酸钾溶液共热被氧化为乙二酸(HOOC-COOH) | |
| D. | 乙苯与酸性高锰酸钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2Mg5Si8O22(OH)2属于硅酸盐 | |
| B. | 昆仑玉是混合物,透闪石中Mg元素与Ca元素的质量比是3:2 | |
| C. | 透闪石的化学式写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O | |
| D. | 透闪石是一种新型无机非金属材料,易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com