
分析 A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大.A和E最外层电子数相同,二者同主族,短周期主族元素的原子中,E原子的半径最大,则E为Na;B、C和F在周期表中相邻,B、C同周期,C、F同主族,则B、C处于第二周期,F处于第三周期,F原子的质子数是C原子质子数的2倍,则C为O元素、F为S元素,可知B为N元素;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),则A为H元素,X为H2O、Y为H2O2;D形成的分子为单原子分子,且原子序数介于氧、钠之间,故D为Ne元素;G的原子序数大于硫,故G为Cl,据此解答.
解答 解:A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大.A和E最外层电子数相同,二者同主族,短周期主族元素的原子中,E原子的半径最大,则E为Na;B、C和F在周期表中相邻,B、C同周期,C、F同主族,则B、C处于第二周期,F处于第三周期,F原子的质子数是C原子质子数的2倍,则C为O元素、F为S元素,可知B为N元素;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),则A为H元素,X为H2O、Y为H2O2;D形成的分子为单原子分子,且原子序数介于氧、钠之间,故D为Ne元素;G的原子序数大于硫,故G为Cl.
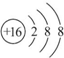
(1)由上述分析可知,D为氖元素,F形成的离子为S2-,离子结构示意图为: ,
,
故答案为:氖; ;
;
(2)液态化合物Y为H2O2,一定浓度的H2O2溶液作消毒剂,故答案为:一定浓度的H2O2溶液作消毒剂;
(3)用某种金属易拉罐与A、C、E组成的化合物NaOH的水溶液反应,产生的气体可充填气球,是Al与氢氧化钠反应生成偏铝酸钠与氢气,该反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)P和Q两种物质都是由H、O、Na、S四种元素组成的盐,其水溶液都显酸性,两物质为NaHSO3、NaHSO4,等物质的量的P和Q恰好完全反应,该反应的离子方程式:H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(5)由H、N两元素形成的化合物W可作为火箭推进器中的强还原剂,一个W分子和一个Y分子中都含有18个电子,则W为N2H4,发生反应:N2H4+2H2O2═N2+4H2O(l),0.5mol液态N2H4反应生成液态水放出408.8kJ热量,则:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ/mol,
又知2H2O2(l)═2H2O(l)+O2(g)△H=-196.4kJ•mol-1,
根据盖斯定律,两式相加可得:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-621.2 kJ•mol-1,
该反应还可设计为原电池(以KOH溶液为电解质溶液),负极N2H4是失去电子,碱性条件下生成氮气与水,电池的负极反应式:N2H4-4e-+4OH-═N2↑+4H2O,
故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-621.2 kJ•mol-1;N2H4-4e-+4OH-═N2↑+4H2O;
(6)由Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,
转化为AgCl沉淀需要的c(Ag+)=$\sqrt{1.56×1{0}^{-10}}$=1.4×10-5mol/L,
转化为Ag2CrO4沉淀需要的c(Ag+)=$\root{3}{2×1.10×1{0}^{-12}}$mol/L>1.4×10-5mol/L,
即AgCl先转化为沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,振荡后砖红色沉淀不溶解即达到滴定的终点,
故答案为:滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,振荡后砖红色沉淀不溶解.
点评 本题以元素推断为载体,考查无机物推断、热化学方程式书写、溶度积的应用、滴定实验等知识,推断元素是解题关键,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和滴定时盛待测的锥形瓶中有少量水对滴定结果无影响 | |
| B. | 在酸碱中和滴定实验中,滴定管都需要润洗,否则引起误差 | |
| C. | 滴定时,左手控制滴定管的活塞,右手握持锥形瓶,边滴加振荡,眼睛注视滴定管中的液面 | |
| D. | 在酸碱中和滴定实验中,滴定前仰视滴定后俯视会引起误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度,2N2O4(g)═4NO2(g)的反应热和化学平衡常数分别为-2△H和K2 | |
| B. | 该反应达到平衡后,缩小容器的容积,平衡右移,混合气体颜色变浅 | |
| C. | 若投入2mol NO2,通过控制外界条件,必能生成1mol N2O4 | |
| D. | 平衡时一定有v正(NO2)=2v逆(N2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com