
【题目】保护环境、保护地球已成为人类共同的呼声。下列措施不利于保护环境的是
A. 积极推广使用新型环保装饰材料
B. 发展清洁煤技术,开展煤的综合利用
C. 控制工业废水和生活污水的排放,改善水体质量
D. 关闭垃圾焚烧处理厂,生活垃圾和工业垃圾全部就地填埋处理
科目:高中化学 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是( )
A.蜂蜜中含有的葡萄糖 B.石油中含有的C16H34
C. 芹菜中含有的纤维素 D.植物油中含有的油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A.氯气可用于自来水消毒 B.甲醛可用作食品防腐剂
C.碳酸钠可用来治疗胃酸过多 D.铝制容器可长期存放碱性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂能增加食物的滋味,增进食欲,保证机体的正常生理功能。但摄入过量脂肪,可导致肥胖、高血脂、高血压等。下列食品中富含油脂的是
A.苹果 B.大米 C.白菜 D.花生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①178O、1②188O、③2311Na、④2412Mg、⑤146C、⑥147N中:
(1)和互为同位素(填序号,下同);
(2)和的质量数相等,但不能互称同位素;
(3)和的中子数相等,但质子数不等,所以不是同一种元素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比, ClO2不但具有更显著的杀菌能力, 而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2 的制备方法中, 有下列两种常用制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为__________________,其中方法二制备的ClO2 更适合用于饮用水的消毒, 其主要原因是 。
(2)我国最近成功研制出制取ClO2 的新方法, 其反应的微观过程如图甲所示:
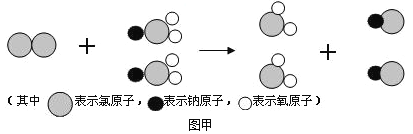
该反应的化学方程式为 。
(3)消毒时, ClO2对污水中Fe2+、Mn2+、S2-和CN— 等有明显的去除效果.某工厂污水中含CN—,现用ClO2将CN—氧化,生成两种无毒气体,其离子反应方程式为 。
(4)自来水厂用ClO2 处理后的水中, 要求ClO2 的浓度在0. 1~0. 8mg/L之间。碘量法可以检测水中ClO2 的浓度,步骤如下:
Ⅰ. 取一定体积的水样用氢氧化钠溶液调至中性, 然后加入一定量的碘化钾, 并加入淀粉溶液, 溶液变蓝。
Ⅱ. 加入一定量的Na2S2O3 溶液。(已知: 2S2O32- +I2 =S4O62- +2I - )
Ⅲ. 重复上述操作2~3次。
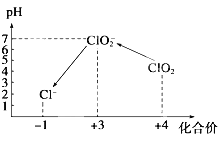
操作时, 不同pH环境中粒子种类如上图所示:
请回答:
①操作Ⅰ中反应的离子方程式是 ;
②确定操作Ⅱ恰好完全反应的现象是 ;
③若水样的体积为1. 0 L, 在操作Ⅱ时消耗了1. 0×10 -3 mol/L的Na 2 S 2 O 3 溶液10 mL, 则水样中ClO2 的浓度是 mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数的说法正确的是( )
A. 化学平衡发生移动,平衡常数必发生变化
B. 平衡常数发生变化,化学平衡必发生移动
C. 改变浓度,平衡常数一定改变
D. 催化剂改变达到平衡的时间,必引起平衡常数的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2![]() 2NaCl+Br2
2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O![]() 4Al(OH)3↓+3NaCl
4Al(OH)3↓+3NaCl
C.2H2S+SO2![]() 2H2O+3S↓
2H2O+3S↓
D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com