
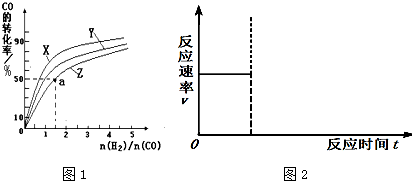
| 1 |
| 2 |
| 1 |
| 2 |
| c(CH3OH) |
| c2(H2)?c(CO) |
| 0.5mol/L |
| (0.5mol/L)2��0.5mol/L |
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������е���̼������Һ��CO32-+2H+=H2O+CO2�� |
| B��������ϡ���ᷴӦ��2Fe+6H+=2Fe3++3H2�� |
| C�������е�������������Һ��HCl+OH-=H2O+Cl- |
| D��ϡ�������ʯ��ʯ�ϣ�CO32-+2H+=H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
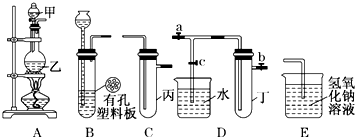
| ʵ����� | ʵ����� | ���� | ���� |
| �� | ����ˮ����Ʒ����Һ | Ʒ����Һ��ɫ | ������Ư���� |
| �� | ��ˮ�м���̼�����Ʒ�ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
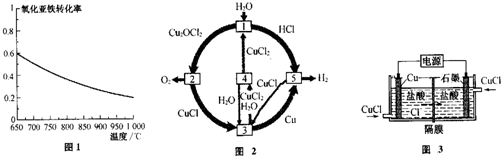
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10��15����c��NH3�� ����������0.25mol?L-1 |
| B��10���ڰ�����ƽ����Ӧ����Ϊ0.025mol?L-1?s-1 |
| C����ƽ����������NH3��v������ |
| D���÷�Ӧ���淴Ӧ�Ļ�ܲ�С��92.2kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
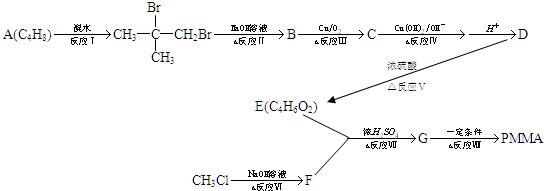
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

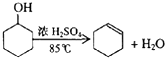
| �ܶȣ�g/cm3�� | �۵㣨�棩 | �е㣨�棩 | �۵㣨�棩 | |
| ���Ҵ� | 0.96 | 25 | 161 | ������ˮ |
| ����ϩ | 0.81 | -103 | 83 | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ӧ�л�ԭ������NO |
| B����������ͻ�ԭ��������ʵ���֮��Ϊ1��8 |
| C����Ӧ������ת�Ƶĵ�����Ϊ4e- |
| D����ѧ����ʽ�а�����˳��ļ������ǣ�8��2��5��1��4��1��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
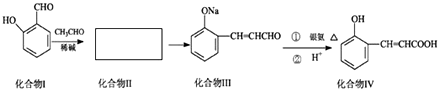
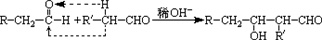
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com