


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
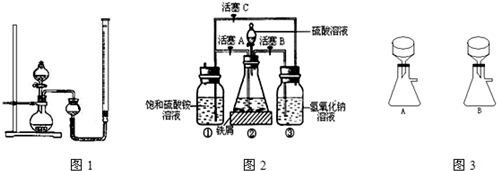
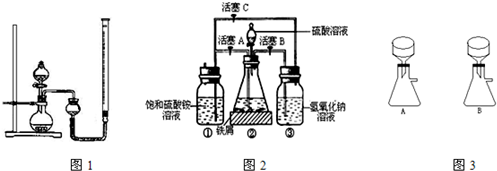
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
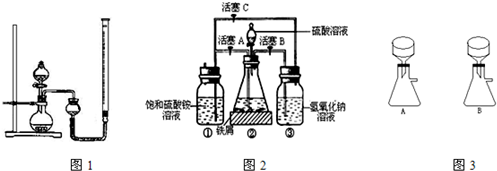
| -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
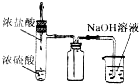
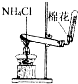
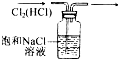
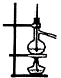
选用图中所列仪器和导管组装实验装置。
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
导 管 及 仪 器 |
|
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | |||||||
(1)气体发生器置于左侧,气体向右方流动,所用仪器与导管依次连接序号为6接______接______接______接______接______。
(2)进行实验时的操作如下(每项进行一次):
①从分液漏斗中逐滴把无水酒精加入烧瓶中,并控制反应速率,酒精加完后关闭活塞;
②在广口瓶中注入适量的水;
③待烧瓶冷却到室温后对量筒读数;
④把定量的V mL酒精无损地倒入分液漏斗中;
⑤检查装置的气密性;
⑥预先将小钠块在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,塞紧橡皮塞;
⑦估计反应接近完成,用酒精灯对烧瓶略加微热,使反应完成,再撤掉酒精灯。
正确的操作序号是______。
(3)①利用96%的乙醇制无水酒精的方法是 ________________________。
②将小钠块制成小钠珠的目的是 _______________________________。
(4)出现下列情况时,对实验结果的影响怎样?(A. 偏高 B. 偏低 C. 无影响 )
①此反应是放热反应,反应速率太快,使实验结果________________。
②如果无水酒精中混有少量甲醇,使实验结果____________________。
③读数时,如果量筒内的液面高于广口瓶内的液面,使实验结果__________。
(5)如果此实验的数据视作标准状况下的数据,无水乙醇的密度为ρg·cm-3, V mL乙醇反应完全后,量筒内的液面读数为m mL,则乙醇分子中能被取代的氢原子数是________ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市萧山中学高三(下)月考化学试卷(3月份)(解析版) 题型:填空题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
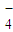 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com