
【题目】某有机物的结构简式如下:
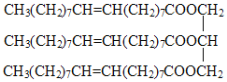
试回答下列问题。
(1)有机物属于________(填序号,下同)。
A.烯烃 B.酯 C.油脂 D.酸
(2)该有机物的密度________。
A.比水大 B.比水小
(3)该有机物在常温下呈________。
A.液态 B.固态 C.气态
(4)与该有机物能发生反应的物质有________。
A.![]() 溶液 B.溴水 C.乙酸 D.H2
溶液 B.溴水 C.乙酸 D.H2
【答案】BC B A ABD
【解析】
从结构简式可以看出,该有机物分子内含有3个酯基、3个碳碳双键,每个烃基中含有的碳原子数都大于10,属于高级脂肪酸甘油酯。
(1)有机物分子内含有氧元素,不属于烃;含有-COO-,属于酯;每个烃基中碳原子数都大于10,属于油脂;分子内不含有-COOH,不属于酸,故该有机物属于BC。答案为:BC;
(2)该有机物属于油脂,密度比水小,故选B。答案为:B;
(3)该有机物分子内含有碳碳双键,属于油,在常温下呈液态,故选A。答案为:A;
(4)该有机物分子内含有-COO-,能与NaOH溶液反应(发生水解反应),含有碳碳双键,能与溴、氢气发生加成反应,但不能与乙酸发生反应,故能发生反应的物质有ABD。答案为:ABD。


科目:高中化学 来源: 题型:
【题目】恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )

A.反应2NO(g) + O2(g) = 2NO2(g)的H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×104 mol·L1,NO 平衡转化率为 50%,则平衡常数 K=2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用二氧化氮表示的平均反应速率为_______mol/(L·s)。
(2)该反应的平衡常数K的数值为____。
(3)若在相同条件下最初向该容器中充入四氧化二氮气体,要达到上述平衡状态,四氧化二氮的起始浓度是______mol·L-1。
(4)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
(5)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_______(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A.18g H216O 和20g H218O 含有的质子数均为10NA
B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D.反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
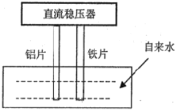
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积不变的密闭容器中发生反应:![]() ,下列不能说明该可逆反应已经达到平衡状态的是( )
,下列不能说明该可逆反应已经达到平衡状态的是( )
A. 混合气体压强不再发生变化B. 混合气体质量不再发生变化
C. 反应中CO与![]() 的物质的量之比为1:1D. 生成n mol CO的同时生成n mol
的物质的量之比为1:1D. 生成n mol CO的同时生成n mol ![]() (g)
(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以C、CO、CO2、CH4等含1个碳原子的物质为原料,可以合成一些化工原料和燃料。
(1)碳原子的核外电子排布式是___,其最外层有___种运动状态不同的电子。
(2)上述物质中属于非极性分子的是___。
(3)合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质。
①用合成气制备二甲醚时,还产生了一种常温为液态的氧化物,写出制备二甲醚的化学方程式____。
②仅用合成气为原料不可能合成的物质是___(填字母序号)。
a.甲醇 b.乙二醇 c.乙二酸 d.尿素
工业上可用CO2生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)+Q(Q>0)。在2L的密闭容器中,发生上述反应:测得n(CO2)和n(CH3OH)随时间变化如图所示。
CH3OH(g)+H2O(g)+Q(Q>0)。在2L的密闭容器中,发生上述反应:测得n(CO2)和n(CH3OH)随时间变化如图所示。

(4)该反应的化学平衡常数的表达式K=___,如果平衡常数K减小,平衡___(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(5)从反应开始到平衡,H2的平均反应速率v(H2)=___。
(6)为了提高CH3OH的产量,理论上可以采取的合理措施有___、___(任写2条措施)。
(7)常温常压下,16g液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是:
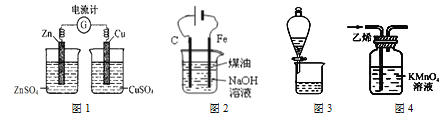
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料乙醇的生产过程示意图如图所示:
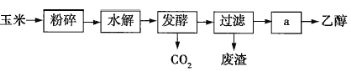
(1)粉碎玉米的目的是__________________________________。
(2)玉米中所含有机物的主要成分是________(填名称)。
(3)步骤a的操作是________(填名称)。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的![]() 的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
(5)用葡萄糖制乙醇的化学方程式可表示为![]() 。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com